Стероїди (грец. steros — твердий + eidos — вигляд) — клас органічних сполук, в основі структури яких лежить циклопентанпергідрофенантрен, або стеран. Ця система складається з трьох конденсованих циклогексанових кілець (А, В та С) і циклопентанового кільця D.
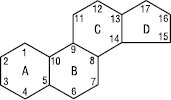
Стеран
З погляду стереохімії стеран може існувати у трьох просторових конфігураціях кілець А, В, С і Д: група 5 α має орієнтацію цис-транс-транс; група 5 β — С. з конфігурацією транс-транс-транс; група кардіостероїдів з цис-транс-цис розташуванням кілець, що відрізняє аглікони серцевих глікозидів від інших природних С., в яких кільця С/Д займають транс-положення.
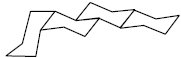
Цис-транс-транс
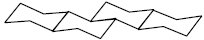
Транс-транс-транс
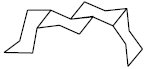
Цис-транс-цис
Подібно до інших ізопреноїдів, біосинтез стероїдів відбувається з ацетил-КоА через мевалонову кислоту, з якої утворюються ізопренові фрагменти (див. Сапоніни). Загальний біогенетичний попередник стероїдів — сквален; епоксид останнього циклізується, окиснюється з подальшим відщепленням декількох атомів вуглецю й перетворюється на ланостерол у тварин або циклоартенол у рослин (див. Циклоартани). Основна маса стероїдів знаходиться в мікросомах (мембранах ендоплазматичного ретикулуму) і в мітохондріях. Різні види стероїдів широко розповсюджені в природі і зустрічаються в мікроорганізмах, рослинах і тваринах. Більшість С. містить –СН3-групи в положеннях С-10 і С-13, –ОН-групу (або кетогрупу) біля атому С-3 і бічний ланцюг — у С-17. Залежно від характеру замісників біля С-17 і наявності –СН3-груп розрізняють похідні естрану, андростану, прегнану, холану і холестану.
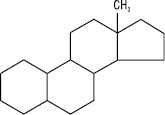
Естран
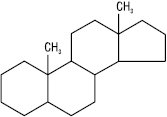
Андростан
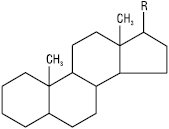
Прегнан — R=CH2CH3;
холан — R=CH(СH3)CH2CH2CH3;
холестан — R=CH(СH3)(CH2)3CH(CH3)2
Стероїди — порівняно неполярні (гідрофобні) сполуки. Завдяки окремим полярним групам, гідрокси- чи оксогрупі вони можуть виявляти амфіфільні властивості. Найбільше ці властивості виражені у солей жовчних кислот (див. Кислоти жовчні). Майже всі Стероїди — кристалічні речовини, оптично активні, краще розчиняються в органічних сполуках, ніж у воді. Характерною особливістю вторинних спиртів групи С27–С29 тваринного або рослинного походження є їх існування у кристалічному вигляді з Тпл у межах 100–200 °С.
До стероїдів належать стероли; жовчні кислоти та жовчні спирти містять карбоксильну або гідроксильну групу в бічному ланцюгу, сприяють перетравлюванню їжі в кишечнику хребетних; сигнальними речовинами, які регулюють обмін речовин, ріст і репродуктивні функції організму, є стероїдні гормони (див. Гормони), зокрема статеві гормони (прогестерон, андрогени, естрогени) і кортикостероїди (гормони кори надниркової залози), подібні сигнальні С. зустрічаються в рослинах; стероїдні сапогеніни (див. Сапоніни) характерні для рослин родин лілійних, пасльонових, ранникових, діоскорейних, агавових та ін., у вигляді глікозидів вони проявляють поверхнево-активні й гемолітичні властивості; кардіостероїди — геніни серцевих глікозидів (див. Серцеві глікозиди), які містять у С-17 ненасичений п’ятичленний (карденоліди) або шестичленний (буфадієноліди) лактонний цикл, проявляють кардіотонічну дію; стероїдні алкалоїди (див. Глікоалкалоїди); вітаміни групи D (див. Вітаміни) є ненасиченими похідними стеринів, які беруть участь у регуляції обміну кальцію й формуванні скелета у хребетних; екдистероїди (див. Екдистероїди) — більш рання щодо еволюції форма похідних холестану, до яких належать екдизони, або гормони линяння комах, що посилюють процеси білкового обміну, мають психостимулювальну та адаптогенну дію. Стероїдними лактонами рослинного походження є вітаноліди і брасиноїди; деякі С. амфібій та голкошкірих є досить сильними нервово-паралітичними отрутами (батрахотоксин, буфотоксин з групи буфадієнолідів, гонотурин А).
Стероли (стерини) — це високомолекулярні циклічні спирти, що у вільному стані або у вигляді складних ефірів містяться в організмі людини, більшості тварин і рослин. Усі стерини містять β-гідроксильну групу при С-3 і один чи кілька подвійних зв’язків у кільці В та бічному ланцюгу при С-17. У молекулах стеринів відсутні карбоксильні і карбонільні групи. Вільні стероли та їх похідні входять до складу клітинних мембран усіх організмів (за винятком бактерій) та використовуються на утворення фізіологічно активних речовин. Із тваринних стеролів найпоширенішим є холестерол (див. Холестерол), з якого утворюються жовчні кислоти, гормони кори надниркової залози та статеві гормони. Рослинні стероли (фітостерини) за хімічною будовою дещо відрізняються від тваринних. До них належать ситостероли і стигмастерол, що є в рослинних жирних оліях. Серед групи ситостеролів найважливішим є малотоксичний β-ситостерол. Він перешкоджає згортанню холестеролу у крові, має протизапальну і противиразкову дію, у вільному стані та у вигляді глікозидів міститься у фітопрепаратах із коренів кропиви (Radices Urticae) і насіння гарбуза (Semina Cucurbitae), які застосовують при запаленні передміхурової залози. У дріжджах і грибах міститься ергостерол, після УФ-опромінювання він перетворюється на кальциферол (вітамін D2).
Стероїди застосовують у медицині, ветеринарії та тваринництві. Освоєні хімічні та мікробіологічні технології напівсинтезу стероїдних гормонів із природної сировини (стеринів, жовчних кислот, сапонінів, глікоалкалоїдів), а також методи їх повного хімічного синтезу. Велике значення має синтез штучних стероїдних гормонів із спеціалізованою фізіологічною дією (контрацептивною, анаболічною та ін.). Фармацевтична промисловість випускає велику кількість препаратів на основі серцевих глікозидів, стероїдних сапонінів, стероїдних алкалоїдів, екдистероїдів та ін.
БСЭ. — М., 1974. — Т. 15; Губський Ю.І. Біологічна хімія. — К.–Тернопіль, 2000; Гудвин Т., Мерсер Э. Введение в биохимию растений: В 2 т. — М., 1986. — Т. 2; Основні біохімічні поняття, визначення і терміни. — К., 1993; Физер Л., Физер М. Стероиды. — М., 1964; Хефтман Э.М. Биохимия стероидов. — М., 1972; Heftmann Е. Biochemistry of plant steroids // Ann. Rev. Plant Physiol. — 1963. — Vol. 14; Kruskemper Н.L. Anabolic steroids. — New York, 1968; The sex steroids / Ed. K.W. McKerns. — New York, 1971.
