САПОНІНИ (лат. sapo — мило) — біологічно активні глікозиди рослинного походження, більшість з яких виявляє поверхневу та гемолітичну активність і токсичність відносно холоднокровних тварин. Водні розчини С. або витяжки із сапоніноносної сировини утворюють при їх струшуванні стійку піну, внаслідок чого ці речовини й одержали назву С. Їх молекула, як і інших глікозидів, складається з цукрової частини та аглікону — сапогеніну. Сапогеніни — поліядерні сполуки, що містять гідроксильні, метильні та карбоксильні групи. Залежно від хімічної структури аглікону С. поділяють на дві групи: стероїдні та тритерпенові. Водні розчини стероїдних С. мають нейтральну рН, тому їх називають нейтральними С. При розчиненні у воді тритерпенові С. зазвичай утворюють розчини кислої реакції, тому їх називають кислими С. Стероїдні С. належать до 27-стеролів (похідні циклопентангідрофенантрену, або стерану). Метаболічні перегрупування ведуть до утворення стероїдних С. спіростанолового чи фуростанолового типу. Спіростаноловий тип С. (монодесмозиди) складається із 6 циклів (А, В, С, D, E, F), які можуть мати різну просторову орієнтацію та утворювати нормальний та ізоряди. Спірокетальна система утворюється за рахунок бічного ланцюга з восьми вуглецевих атомів і гідроксилу у С16 (див. Якірці, Діоскорея). С. фуростанолового типу (бісдесмозиди) мають 5 циклів: А, В, С, D, Е, а F-кільце у них розімкнене і в положенні С27 спиртова група етерифікована глюкозою. У процесі гідролізу бідесмозидів глюкоза у С27 відщеплюється за рахунок гідроксильної групи, що вивільняється, відбувається замикання бічного ланцюга у спірокеталь, тобто фуростанолові С. можуть легко перетворюватися на спіростанолові. Прикладом є сарсапарилозид із сарсапарилю (Smilax medica Sclecht. Et Cham., Liliaceae), здавна відома речовина, яка довго залишалася єдиною ефективною для лікування сифілісу.
Аглікони завжди містять ОН-групу у С3 й іноді в положеннях С1, С2, С5 і С12; багато сапогенінів у положенні 5-6 мають подвійний зв’язок, у положеннях С10 та С13 бувають метильні й метоксильні групи. Відомі аналоги стероїдних С., які містять азот замість кисню в спірокетальній групі. Ці сполуки є похідними спіросолану; вони виявляють основні властивості та належать до стероїдних алкалоїдів, або глікоалкалоїдів. Аглікон складається з 30 атомів вуглецю. За кількістю циклів тритерпенові С. поділяють на тетрациклічні та пентациклічні. Попередником усіх тетрациклічних С. і стероїдів є циклоартенол (див. Циклоартани). Пентациклічні тритерпеноїди можуть мати циклопентанове або циклогексанове кільце Е; їх поділяють на декілька типів: С. групи α-амірину, β-амірину, лупеолу, фриделіну, церину та ін. Найпоширеніші у рослинах пентациклічні тритерпеноїди: похідні α-амірину, напр. олеанолова та гліцеритинова кислоти, менше — похідні β-амірину (напр. урсолова кислота).
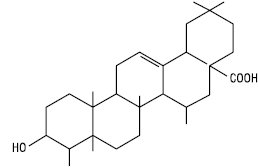
Олеанолова кислота
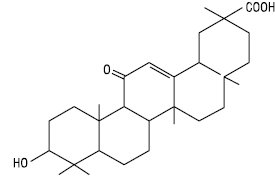
Гліцеритинова кислота
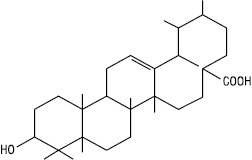
Урсолова кислота
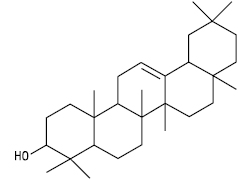
β-Амірин
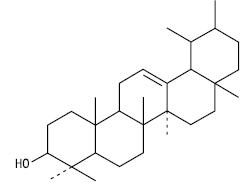
α-Амірин
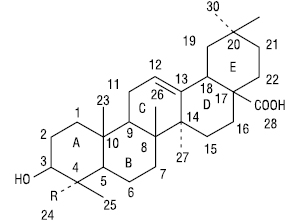
| R | ||
| CH3 | — | Олеанолова кислота |
| CH3 | 16α | Ехіноцистова кислота |
| CH2OH | — | Гедерагенін |
| CHO | — | Гіпсогенін |
| CHO | 16α | Квілаєва кислота |
Тип β-амірину. Похідні олеанолової кислоти
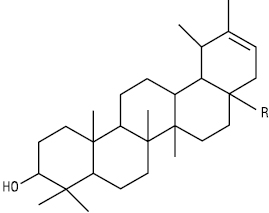
| R | |
| Н | Тараксастерол |
| ОН | Арнідіол |
| ОН | Фарадіол (просторовий ізомер арнідіолу) |
Тип α-Амірину
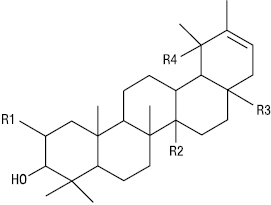
| R1 | R2 | R3 | R4 | |
| H | CH3 | CH3 | H | α-Амірин |
| H | CH3 | COOH | H | Урсолова кислота |
| H | COOH | COOH | H | Хінова кислота |
| OH | CH3 | COOH | OH | Торментилова кислота |
| H | CH3 | OH | H | Кратегова кислота |
Функціональні групи тритерпенових С. різноманітні: гідроксильні радикали заміщають С3, С16, С21, С2 або С24 положення; трапляються карбоксильні групи (С25, С28, С29), рідше — метоксильні й карбонільні радикали (С11, С25), часто утворюються прості та складні етери.
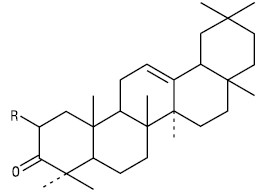
Тип α-Амірину
R = H Фріделін
R = OH Церин
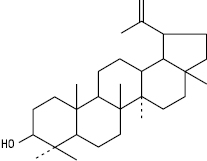
Лупеол
Подвійний зв’язок найчастіше наявний в положенні 12–13. Сапогеніни, що мають альдегідну групу або етерні зв’язки, нестійкі й можуть змінюватися у процесі екстракції з ЛРС. Особливістю пентациклічних С. є наявність у структурі карбоксильних груп і кислих цукрів. У вуглеводній частині молекули С., яка може містити від 1 до 11 моносахаридів, виявлені D-глюкоза, D-галактоза, D-ксилоза, L-арабіноза, D-хіновоза, L-рибоза, D-фукоза, L-рамноза, D-глюкуронова і D-галактуронова кислота. Частіше глікон приєднується до С3; у біозидів із двома вуглеводними ланцюгами глікозидується також карбоксильна група. Вуглеводні ланцюги бувають лінійними чи розгалуженими. Гідроксильні групи можуть ацилюватися залишками органічних кислот, напр. оцтової, ангелікової, тиглінової, коричної, пропіонової та ін.
Тетрациклічні тритерпенові С. можна поділити на дві підгрупи: дамарану (див. Панакс) і циклоартану. Похідні циклоартану містяться в рослинах родин бобові, ранникові, молочайні та ін.
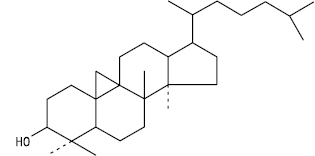
Тип циклоартану. Циклоартан-3-ол
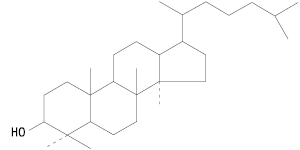
Тип дамарану. Дамаран-3-ол
Тритерпенові С. мають загальний шлях біосинтезу із стероїдами, біохімічним попередником яких є в більшості сквален-2,3-оксид. Деякі пентациклічні тритерпеноїди: диплоптен, серотен, гопен, фернен (Polypodium vulgare) — утворюються безпосередньо зі сквалену (схема).
![saponiny_12 [Converted].ai](/uploads/2016/09/saponiny_12%20%5BConverted%5D.jpg)
Схема біосинтезу терпеноїдних сполук
Більшість С. безбарвні, білі чи жовтуваті аморфні речовини без чіткої Тпл (з розкладанням). У кристалічному вигляді отримано С., що містять не більше 4 моносахаридів. Сапогеніни — кристалічні речовини з чіткою Тпл. Розчинність С. залежить від кількості моносахаридів, що входять до їх складу. С., які містять 2–4 цукрових залишки, розчиняються у воді погано, але зі збільшенням їх кількості розчинність С. підвищується. Гірше С. розчиняються в етиловому та метиловому спирті. При нагріванні розчинність у спиртах підвищується, але при охолодженні розчинів С. випадають в осад. В етері, хлороформі, ацетоні та інших органічних розчинниках С. не розчиняються. Водні розчини та водні настої ЛРС, що містять С., при струшуванні утворюють стійку піну (деякі при розведенні 1:100 000) завдяки властивостям детергентів (зменшують поверхневий натяг на межі води та повітря). Піна С., на відміну від мильної, має нейтральну чи кислу реакцію. Властивість піноутворення є специфічною реакцією С. і використовується для якісного і кількісного визначення їх у рослинах, але відомі С., розчини яких при струшуванні не піняться. Багато С. утворюють комплекси з білками, стеринами, фенольними сполуками; за карбоксильною групою можуть приєднуватися катіони. Усі С. гідролізуються сильними кислотами. Стероїдні С. мають характерну особливість утворювати з вищими спиртами нерозчинні у воді комплексні сполуки. Найхарактернішою особливістю більшості С. є властивість викликати гемоліз — руйнування еритроцитів з вивільненням гемоглобіну, що пояснюється здатністю С. утворювати комплекси з холестерином мембран еритроцитів. Мембрани без холестерину стають перфорованими, внаслідок чого порушується ліпоїдна частина оболонки еритроцитів, яка перетворюється з напівпроникної на проникну, а гемоглобін з еритроцитів переходить у плазму крові; кров стає яскраво-червоною, прозорою. Сапогеніни не виявляють гемолітичної активності. Гемоліз С. вперше описаний російським лікарем Л. Федотовим (1875). Гемоліз широко використовується для якісного та кількісного визначення С. у рослинах. С. дуже багато в рослинах, менше — у тваринних організмах. С. виявлено у 900 видах рослин, що належать до 90 родин. Пентациклічні тритерпенові С. містяться в рослинах 40 родин: бобових, гвоздичних, айстрових, аралієвих, китяткових, селерових, ясноткових та ін. З вищих спорових рослин містять тритерпенові С. деякі види папоротей. Стероїдні С. знайдені в обмеженій кількості родин: лілейних, амарилієвих, діоскорейних, ранникових, пасльонових, паролистяних та пальмових. Найбільша кількість видів, що містять стероїдні С., росте в районах із сухим та жарким кліматом. Стероїдні С. містяться в листі наперстянки, у кореневищах діоскореї, у листі деяких видів агави та юки. С. виявлені в усіх частинах рослин, але накопичуються переважно у коренях, кореневищах, бульбах, плодах, значно менше — в корі та надземній частині. Вміст С. у різних видах рослинної сировини коливається у великих межах: від слідів до 20% (мильне дерево) і змінюється залежно від періоду вегетації, кліматичних умов. С. у рослинах можуть бути у вільному стані або в поєднанні з іншими речовинами. Зазвичай у рослинах знаходиться декілька С., один або два з яких домінують. Існують декілька теорій щодо біологічних функцій С. у рослинах: С. — резервні речовини (містять багато цукрів); С. — захисний фактор; С. — проміжна ланка між низькомолекулярними та полімерними органічними речовинами. Тритерпенові С. впливають на проникність рослинних клітин, що пов’язано з їх поверхневою активністю. Певні концентрації С. прискорюють проростання насіння, ріст та розвиток рослин, а концентровані розчини С. — гальмують. Виявлені деякі особливості їх накопичення. Рослини, що містять велику кількість етерної олії, зазвичай мало накопичують С. і, навпаки, при значному вмісті С. рослини бідні на етерні олії. А. Розенталер та Л. Ружичка пояснюють це тим, що ізопрен може мати два шляхи перетворення: один шлях призводить до накопичення терпенів та політерпенів, головних складових частин етерної олії, а інший — до утворення сесквітерпенів і тритерпенів, а потім до накопичення тритерпенових С. Дослідження проводилося багатьма іноземними та вітчизняними вченими, але особливо слід відзначити роботи Л. Ружички зі співавторами — З. Черникової, А. Хорліна, Ю. Оводова, Г. Єлякова та ін. Виділення С. із рослинної сировини має такі стадії: одержання сумарного екстракту; виділення з нього суми С. та їх очищення; розподіл суми С. на індивідуальні сполуки. Сировину попередньо знежирюють тетрахлорметаном, петролейним або етиловим етером для руйнування нерозчинних у воді та водних спиртах комплексів С. та спиртів. Сумарний екстракт С. отримують обробкою сировини полярними розчинниками, метанолом, етанолом, водними спиртами, дуже часто бутанолом, насиченим водою. Методи виділення С. з екстракту залежать від їх будови. Глікозиди з невеликою кількістю сахаридних залишків мало розчиняються у воді й випадають в осад при розведенні спиртових розчинів водою. Полярні С. мало розчиняються у метанолі та етанолі й випадають в осад при охолодженні або при тривалому стоянні спиртових розчинів, або при додаванні спирту до водних та водно-спиртових розчинів. Кислі С. розчиняються у водних розчинах лугів та випадають в осад при підкисленні. Зі спиртових розчинів тритерпенові С. висаджують етером, ацетоном, етилацетатом. З водних розчинів супутні речовини видаляють етером, хлороформом, а тритерпенові глікозиди — бутиловим або ізоаміловим спиртом. Отримані сапонінові фракції очищають переосадженням. Існують методи виділення, що базуються на здатності С. утворювати нерозчинні солі з барію гідроокисом або свинцю ацетатом, комплекси із холестерином, танінами, білками. Солі потім розкладають сульфатною кислотою, холестеринові комплекси — екстрагуванням холестерину бензолом або етером, танінові — екстракцією водною суспензією цинку окису, білкові — екстракцією С. полярними органічними розчинниками. Поширені хроматографічні методи очищення С. з використанням алюмінію оксиду, силікагелю, активованого вугілля. Для ідентифікації С. у рослинних тканинах використовують реакції, які за їх характером можна поділити на три групи: реакції, що базуються на фізичних (реакції піноутворення та визначення хімічної природи С.), хімічних (осадові та кольорові реакції), біологічних властивостях С. (гемоліз). Для якісних реакцій готують водний настій 1:10. Реакції, що ґрунтуються на фізичних властивостях С.: а) реакція піноутворення: 5 мл настою сильно струшують у пробірці, утворюється велика кількість піни, що не зникає протягом 15 хв; б) визначення хімічної природи С.: беруть дві пробірки однакового діаметра; у першу наливають 5 мл 0,1 М розчину хлористоводневої кислоти (рН 1,0), в другу — 5 мл 0,1 М розчину калію гідроксиду (рН 13,0). Потім у кожну пробірку додають по три краплі розчину, який досліджують, і сильно збовтують протягом 1 хв. Якщо в сировині містяться тритерпенові С., у пробірках утворюється піна, однакова за об’ємом та стійкістю. При додаванні екстракту із С. стероїдної групи в лужному середовищі утворюється піна, у декілька разів більша за об’ємом та стійкістю. До реакцій, що базуються на хімічних властивостях С., належать осадові реакції з баритовою водою, розчином свинцю ацетату основного, розчинами солей ртуті, міді, цинку; стероїдні С. висаджують холестерин із спиртового розчину; стероїдну частину С. визначають за реакцією Лібермана – Бурхарда. Для С. характерні реакції забарвлення з реактивами, які містять концентровану сульфатну кислоту та концентровану кислоту з оцтовим ангідридом, з альдегідами: ваніліном, формальдегідом, парадиметилбензальдегідом, із незначними кількостями солей металів тощо — реакції Лафона, Лібермана – Бурхарда, Саньє, Сальковського та ін. Якісні реакції, що наведені вище, недостатньо специфічні. Найхарактернішою реакцією С. є гемоліз. Для визначення гемолітичної активності С. готують водний настій сировини на ізотонічному розчині. До 1 мл фільтрату додають 1 мл 2% суспензії еритроцитів у фізіологічному розчині. Кров стає прозорою, яскраво-червоною. Вірогідні результати дають хроматографічні методи виявлення та ідентифікації С. Для виявлення тритерпенових С. на хроматограмах використовують пари йоду, а також кислі реагенти: спиртовий розчин ваніліну і сульфатної кислоти концентрованої (замість ваніліну може бути n-диметиламінобензальдегід), розчин ваніліну у фосфорній кислоті, насичений хлороформний розчин стибію хлориду (III або V), 25% спиртовий розчин фосфорно-вольфрамової кислоти, сульфатну кислоту концентровану та ін. С. утворюють з цими реактивами полієни, що мають забарвлення від рожевого до фіолетового кольору. Стероїдні С. проявляються у вигляді жовтих плям розчином сульфатної кислоти в оцтовому ангідриді. Для проведення гемолізу на хроматографічну пластинку наливають желатиновий розчин крові та спостерігають гемолітичний ореол. Завдяки дифузії в желатин зони, що відповідають С., прозорі та майже знебарвлені. Однак слід вважати, що не всі С. виявляють гемолітичну активність. Тому найбільш достовірні результати можуть бути одержані при комплексному використанні вищезазначених методів. Для дослідження індивідуальних С. використовують адсорбційну хроматографію, УФ-, ІЧ- ПМР- та мас-спектрометрію, ВЕРХ. Вміст С. визначають гравіметрично, біологічними чи фізико-хімічними методами. Загальних хімічних методів кількісного визначення С. у сировині не існує. Кількісне визначення С. ваговим методом базується на здатності С. осаджуватися з водних розчинів ефіром, міцним спиртом і деякими солями, проте вагові методи не знайшли широкого застосування через складність виділення, очищення суми С. і неможливості встановити вміст індивідуальних С. Тривалий час С. визначали у рослинній сировині за гемолітичним індексом, пінним числом і токсичністю для холоднокровних тварин. Гемолітичний індекс — це найнижча концентрація С., що викликає повний гемоліз еритроцитів протягом 24 год. Визначення проводять із відмитими еритроцитами у фізіологічному розчині в пробірці. За вдосконаленою методикою використовується фільтрувальний папір, просочений розчином С., на який наносять певну кількість досліджуваної суспензії еритроцитів. Утворюється зона гемолізу, діаметр якої прямопропорційний ступеню гемолітичної активності С. Позитивний результат гемолітичної реакції ще не є доказом наявності С., бо інші рослинні речовини (цукор, деякі ефірні олії, органічні кислоти, спирти) також здатні викликати гемоліз еритроцитів. Необхідно враховувати, що гемолітична дія С. блокується холестерином і відновлюється після руйнування цього комплексу. На детергентній властивості розчинів С. базується метод визначення вмісту С. шляхом прямого вимірювання поверхневого натягу або визначення пінності, яка пропорційна ПАР та її концентрації. Показником сапонінності, або пінним числом, називають найнижчу концентрацію настою (зведену до одиниці речовини), що утворює стійку, не зникаючу протягом 1 хв піну. Пінне число — показник, типовий тільки при високому вмісті С. у сировині. Цей метод використовують для попереднього дослідження ЛРС, бо пінність можуть викликати й супутні речовини. Методи визначення С., що базуються на токсичності цих сполук для холоднокровних тварин (риб, пуголовків, жаб, черв’яків), не мають переваг порівняно з гемолітичним індексом або пінним числом і зберігають їх основний недолік — невисоку надійність. Жоден метод не визначає абсолютного вмісту С. Результати, одержані описаними методами, неможливо порівняти, оскільки здатність викликати гемоліз, поверхнева активність і токсичність С. — це властивості, не залежні одна від одної. Зберігати сировину, що містить С., слід у сухому приміщенні в запакованому вигляді для запобігання гідролізу глікозидів і утворенню сапогенінів, що призводить до зниження чи втрати біологічної активності. Сушіння сировини, що містить С., проводять при температурі 50–65 °С.
Тритерпенові С. використовують у медицині, харчовій та легкій промисловості. Вони мають різноманітну фармакологічну активність, більшість з них підсилюють секреторну діяльность залоз, сприяють всмоктуванню інших речовин, зумовлюють відхаркувальну активність: китятки, синюха, первоцвіт, солодка; деякі з них мають сечогінну дію: нирковий чай, хвощ польовий; проносна й антиалергічна, противірусна дія притаманна солодці, її препарати регулюють водно-сольовий обмін. С. тонізують діяльність ЦНС, виявляють гіпотензивний, протизапальний, антимікробний, протиалергічний і кортикостероїдний ефекти. Встановлено, що тритерпенові С., які мають низький гемолітичний індекс, істотно не впливають на перебіг атеросклерозу, але збуджують ЦНС (С. родини аралієвих). Навпаки, С. із високим гемолітичним індексом виявляють виражений антиатеросклеротичний ефект. Чисті С. використовують у лабораторній діагностиці, а також для приготування деяких вакцин. Як емульгатори С. використовують для стабілізації дисперсних систем (емульсій, суспензій). С. застосовують як нейтральні мийні засоби, які, на відміну від лугів, не мають основних властивостей, дають сильну піну, добре емульгують жири і утримують у колоїдному стані бруд. У рослинництві С. використовують для стимулювання проростання насіння та прискорення поділу клітин; сільськогосподарська авіація обробляє посіви препаратами монодесмозидів, які виявляють протигрибкову активність. У біохімічних лабораторіях С. використовують для кількісного визначення стеринів. Стероїдні С. виявилися найбільш економічним і доступним джерелом для напівсинтезу гормональних препаратів, перш за все, кортизону і його аналогів — сполук, які дуже активно впливають на білковий та вуглеводний обмін, сприяють накопиченню цукру в крові та глікогену в печінці. Кортикостероїди мають протизапальну, сенсибілізувальну і протиалергічну дію. Тривалий час кортизон та статеві гормони виробляли з кори надниркової залози великої рогатої худоби, оскільки їх синтез багатостадійний і малорентабельний. Альтернативним доступним і дешевшим джерелом стероїдного ядра стала рослинна сировина, яка містить стероїдні С. та гілікоалкалоїди. Досить відзначити, що 90% всіх синтезованих на сьогодні гормональних препаратів виробляють із діосгеніну і близьких до нього стероїдних С. з різних видів діоскореї (Dioscorea) та юки (Yucca), які постачають із Мексики, Індії та ін. Промислові плантації юки закладені на сході Грузії; налагоджено напівпромислове одержання тигогеніну для напівсинтезу кортикостероїдів.
Протипоказання: через гемолітичну активність С. не можна вводити в/в та підшкірно. С. усмоктуються через неушкоджену шкіру дуже повільно і можуть викликати її запалення або нагноєння. При вдиханні С. виникає подразнення слизової оболонки ВДШ та очей із чханням, кашлем, сльозотечінням. При прийомі всередину низькі дози нешкідливі, високі ж викликають блювання, діарею внаслідок подразнення слизової оболонки ШКТ. Особливо токсичні С. для нижчих хребетних та риб. Завдяки пінності тритерпенові С. використовують у пиво-безалкогольній промисловості, для виготовлення халви та інших кондитерських виробів; цю властивість С. використовують також у вогнегасниках.
Гудвин Т., Мерсер Э. Введение в биохимию растений. — М., 1986. — Т. 2; Cycloartane saponins from Astragalus peregrinus as modulators of lymphocyte proliferation / L. Verotta, M. Guerrini, N.A. El-Sebakhy et al. // Fitoterapia, 2001. — Vol. 72. — № 8; Drogenanalysis. — Berlin–Heidelberg–Tokio, 1983; Plant Drug Analysis: a Thin layer chromatography atlas / H. Wagner, S. Bladt. — Berlin–Heidelberg–New York, 1996; Who monographs on selected medicinal plants. Vol. 2. — World Health Organization. — Geneva, 2002.
