Побічна дія ліків, або побічні ефекти (англ. side effects) — будь-яке виявлення небажаного, тобто невідповідного меті фармакотерапії, іноді небезпечного впливу ліків на організм, що виникає в діапазоні терапевтичних доз (рекомендованих для лікування, діагностики або профілактики захворювань).
Побічна дія ліків є антиподом головної дії, заради якої ЛП застосовуються. Побічна дія ліків різнорідна за виявленням і частотою виникнення, тому потребує різноманітних методичних прийомів. Частота П.д.л. сягає 20% при амбулаторному лікуванні, до 5% хворих потребують госпіталізації для лікування її наслідків. Найчастіше в Україні реєструють П.д.л. при застосуванні антибактеріальних препаратів, кровозамінників, протизапальних, знеболювальних препаратів, препаратів кардіологічного профілю, анестетиків, вітамінів, протипухлинних засобів. Але статистика П.д.л. інколи відображає не стільки відповідні властивості тих чи інших ЛЗ, скільки частоту їх застосування.
Згідно з міжнародною класифікацією, побічна дія ліків підрозділяється на реакції типу А, В, С і D (табл. 1). За механізмом виникнення вона може бути неалергічного і алергічного походження. П.д.л. неалергічного походження переважно включена до групи А, зустрічається найчастіше (до 75% всіх випадків). Вона зумовлена фармакологічними властивостями ЛП, є передбачуваною, залежить від дози препарату (прямо пропорційно), може вивчатися експериментальним шляхом. Подібні види побічних ефектів найбільш типові для ЛП невибіркової дії, а підвищення селективності сприяє зменшенню П.д.л. Напр., блокатори β1,2-адренорецепторів — пропранолол, окспренолол, піндолол та ін. при використанні з гіпотензивною, антиангінальною, протиаритмічною метою (для цих ефектів необхідна блокада β1-адренорецепторів у міокарді) нерідко викликають підвищення тонусу та секреції бронхів, що зумовлено блокадою β2-адренорецепторів. Кардіоселективні препарати: ацебутолол, небіволол, бісопролол та ін. — зазвичай позбавлені цієї П.д.л. Індометацин, ацетилсаліцилова кислота та інші НПЗП — невибіркові ЦОГ 1-го і 2-го типів пригнічують синтез цитопротекторних простагландинів у шлунку, тому часто викликають гастропатію (подразнення слизової оболонки). На відміну від них, селективні та специфічні інгібітори ЦОГ-2 (німесулід, мелоксикам, целекоксиб та ін.) спричиняють гастропатію значно рідше. Діазепам — транквілізатор, що стимулює ГАМК-ергічні процеси завдяки активації бензодіазепінових рецепторів, може стати причиною небажаної сонливості та міорелаксації при лікуванні тривожних розладів, але анксіоселективний препарат афобазол позбавлений цього виду П.д.л. (див. Анксіолітичні (атарактичні) препарати). Лікарську залежність здатні викликати ЛП, що спричиняють ейфорію або галюцинації — кетамін та ін. (див. Галюцинації). До нечастих виявів П.д.л. неалергічної природи належить ідіосинкразія (див. Ідіосинкразія), тобто природжена підвищена чутливість до ліків. Напр., у осіб з генетичним дефектом (низькою активністю) ферменту холінестерази в крові деполяризуючий міорелаксант дитилін може викликати дуже тривале — до декількох годин — розслаблення скелетних м’язів з порушенням дихання. Причини та механізми ідіосинкразії вивчає фармакогенетика (див. Фармакогенетика).
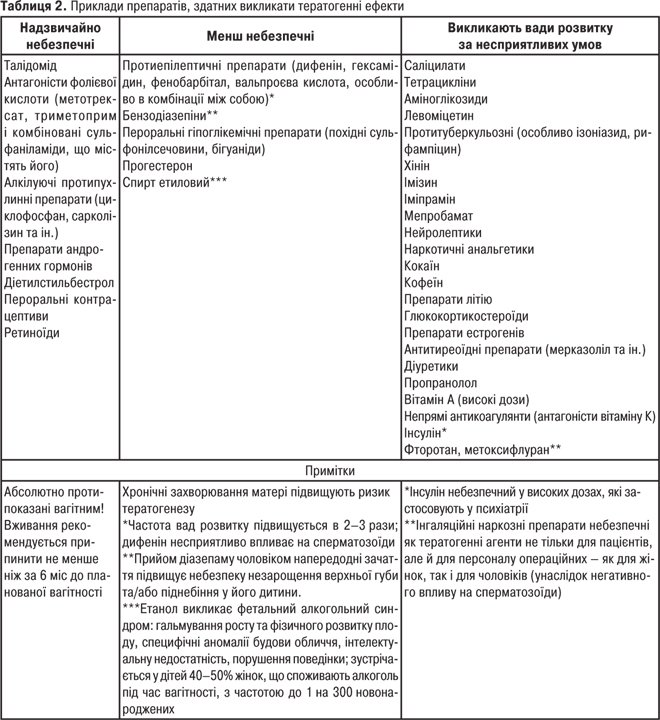
До П.д.л. належать небезпечні ефекти, що виникають при застосуванні ЛЗ у вагітних у зв’язку з проникненням лікарських речовин та/або їхніх метаболітів із судинного русла матері в зародок або внутрішньоутробний плід. Це ембріотоксична, тератогенна та фетотоксична дія. Ембріотоксична дія є ушкодженням зиготи чи зародка, що знаходиться в просвіті маткової труби або порожнини матки, тобто до імплантації — в перші 3 тиж після запліднення. Ушкодження і навіть загибель зародка можуть викликати, зокрема, естрогенні, гестагенні гормональні препарати, дезоксикортикостерону ацетат, соматотропний гормон, саліцилати, барбітурати, сульфаніламіди, цитостатики і ряд інших ксенобіотиків, напр. нікотин. Тератогенна дія (від лат. teras — виродок) — виникнення вад розвитку внутрішніх органів, ЦНС, кінцівок у зародка, тобто потворності. Небезпека тератогенної дії ліків стала очевидною в кінці 50-х рр. ХХ ст. після того, як в Західній Європі у жінок, що вживали седативний і снодійний препарат талідомід, народилося близько 7 тис. дітей з вадами розвитку кінцівок (унаслідок порушення синтезу колагену в кістковій тканині), ШКТ, гемангіомами на обличчі та ін. Частіше тератогенна дія розвивається в І триместр, особливо від початку 4-го до кінця 8-го тижня вагітності, тобто в період закладки органів. Конкретний вид вади залежить від терміну вагітності — від того, які саме органи закладаються та інтенсивно формуються під час застосування ліків. Вірогідність його розвитку визначається не тільки препаратом, що застосовується, але й віком вагітної (ризик підвищується у віці ≤17 або ≥ 35 років, коли частіше зустрічається пренатальне ушкодження яйцеклітин), станом здоров’я жінки (особливо захворювання органів, які елімінують ліки та їхні метаболіти — печінки, нирок, а також серцево-судинної та ендокринної системи), генетичними особливостями батьків і внутрішньоутробного плоду, дозою препарату, тривалістю його застосування. Серед причин вроджених вад розвитку до 25% становлять генетичні порушення, близько 10% — інфекції (корова краснуха, грип та ін.), опромінювання, травми. Приблизно у 65% випадків причини залишаються нез’ясованими, і значна їх частина пояснюється дією ліків або ксенобіотиків. За ступенем небезпеки тератогенної дії ліки поділяють на 3 групи (табл. 2). Важливо, що тератогенна дія може виникати не тільки внаслідок трансплацентарного надходження ліків (ксенобіотиків) в організм плоду, але й внаслідок їх дії на організм батька напередодні зачаття, що може викликати генетичні аномалії сперматозоїдів, порушення їхньої життєздатності, рухливості. Потрапляючи з сім’яною рідиною в статеві шляхи жінки, лікарська речовина може діяти локально, порушуючи ранні етапи вагітності.
Фетотоксична дія (від лат. foetus — плід) — це несприятливий вплив ліків на стан внутрішньоутробного плоду (частіше — в останні тижні вагітності) та новонародженого. Так, β2-адреноміметики (партусистен), вживані з метою зниження скоротливої активності матки, провокують гіперглікемію плоду та як наслідок — стимуляцію секреції інсуліну, який повільно виводиться з організму внутрішньоутробної й новонародженої дитини, сприяє гіпоглікемії в неонатальний період. Ці препарати можуть викликати також метаболічний ацидоз, гіпербілірубінемію, гіпокальціємію, непрохідність кишечнику. Сульфат магнію, що теж застосовують з токолітичною метою, внаслідок пригнічення ЦНС плоду здатний викликати м’язову слабкість, порушення дихання й смоктання у новонародженого.
Аміноглікозидні антибіотики (стрептоміцин, гентаміцин та ін.) уражують внутрішнє вухо, що може порушити слух аж до глухоти. Індометацин та інші НПЗП, що гальмують синтез простагландинів, сприяють передчасному закриттю артеріальної протоки; це порушує кровообіг і стає причиною серцевої недостатності та навіть загибелі плоду, а після народження провокує у дитини легеневу гіпертензію. Крім того, препарати цієї групи знижуючи сечоутворення у внутрішньоутробного плоду, зменшують кількість амніотичної рідини, що гальмує рухову активність і затримує розвиток дитини, а також легко викликають кровотечу у плода і новонародженого. При використанні ЛП матерями, що годують грудьми, можливі виявлення П.д.л. у дитини, в організм якої препарат потрапляє з материнським молоком. Зокрема, антикоагулянти в таких випадках можуть викликати кровотечу, сульфаніламіди — гемоліз.
Одним з видів побічної дії ліків є мутагенна дія, тобто здатність викликати зміни спадкової інформації — мутації — в статевих і соматичних клітинах (див. Мутації). Дослідження мутагенності нових АФІ і допоміжних речовин проводиться на етапі доклінічного вивчення безпеки їх застосування з використанням комплексу методів на різних тест-об’єктах. Зокрема, здійснюється облік хромосомних аберацій або мікроядер у клітинах кісткового мозку ссавців і облік генних мутацій у мікроорганізмів або дрозофіл, а перед другою фазою клінічних випробувань — вивчення здатності ЛП індукувати мутації в зародкових клітинах мишей (домінантний летальний тест). У разі отримання неоднозначних результатів в окремих тестах досліджується рівень хромосомних аберацій в лімфоцитах периферичної крові хворих, що одержували препарат. Тестуванню на мутагенну активність піддаються оригінальні ЛП, створені хімічними, біотехнологічними, генно-інженерними та іншими способами, зокрема з сировини природного походження. Нові фіксовані комбінації лікарських речовин при структурній схожості компонентів з відомими мутагенами, канцерогенами або їх метаболітами також потребують випробування на мутагенність. Висновок про наявність мутагенних властивостей у досліджуваного ЛП роблять у разі, якщо мутагенний ефект зареєстровано хоча б в одному тесті.
До небезпечних проявів П.д.л. належить також канцерогенна дія (від лат. cancer — рак), тобто здатність викликати злоякісні пухлини. Вона тісно пов’язана з мутагенними властивостями ліків. Клінічні випробування і впровадження у виробництво нових ЛП і допоміжних речовин здійснюються за наявності результатів оцінки його потенційних канцерогенних властивостей. Обов’язковому експериментальному тестуванню на канцерогенність піддаються новостворювані ЛП, призначені для застосування як лікувально-профілактичні, косметичні, репелентні, контрацептивні, для застосування тривалими повторними курсами, в дитячій практиці, у період вагітності і годування грудьми, для безрецептурного відпуску. Дослідження на канцерогенність дуже важливе за наявності у препаратів цитостатичних, гормоноподібних властивостей, здатності стимулювати проліферацію клітин. Крім того, такі дослідження необхідні за наявності клініко-епідеміологічних даних про канцерогенний ризик при використанні в лікувальній практиці їх аналогів, у разі мутагенних властивостей або здатності до ковалентного приєднування до ДНК.
Побічна дія ліків може бути первинною і вторинною. Первинна є прямим наслідком впливу препарату на певну мішень (нудота, біль в епігастрії та інші прояви диспепсії при подразненні слизової оболонки шлунка). Вторинна П.д.л. виникає непрямим шляхом (напр. гіповітаміноз при антибіотикотерапії внаслідок пригнічення кишкової мікрофлори, що синтезує вітаміни). П.д.л. алергічної природи виявляється у вигляді сенсибілізації організму завдяки антигенним властивостям ЛП та/або їх метаболітів, комплексів лікарських речовин з білками крові, компонентами клітинних мембран та ін. з подальшим розвитком алергічних реакцій (див. Алергія). До числа найбільш алергонебезпечних ліків належать, зокрема, антибіотики, кровозамінні препарати, вітаміни. Алергічні прояви П.д.л. є дозонезалежними: їх тяжкість не завжди корелює з дозою препарату, і навіть невисока доза може стати такою, що викликає дуже тяжку реакцію аж до анафілактичного шоку (див. Анафілактичний шок, Шок). Алергічні реакції І типу (кропив’янка, судинний набряк, риніт, бронхоспазм, анафілактичний шок) досить часто викликають пеніциліни, сульфаніламіди; ІІ типу — метамізол, або анальгін (агранулоцитоз), метилдопа (гемоліз), хінідин (тромбоцитопенія); ІІІ типу (так звана сироваткова хвороба — кропив’янка, біль у суглобах, лімфаденопатія, лихоманка) — пеніциліни, сульфаніламіди, йодиди; IV типу (контактний дерматит) — різні ліки при місцевому застосуванні. Можлива перехресна алергія, коли в сенсибілізований організм уводиться речовина, хімічно близька до тієї, що викликала сенсибілізацію, і тому здатна взаємодіяти з імуноглобулінами, індукуючи алергічну реакцію. Перехресні алергічні реакції викликають, зокрема, β-лактамні антибіотики (різні представники пеніцилінів, пеніциліни з цефалоспоринами), сульфаніламіди, похідні сульфонілсечовини. Для профілактики алергічних виявів П.д.л. необхідний ретельний збір алергологічного анамнезу, проведення спеціальних проб. За клінічними проявами до алергічних реакцій близькі псевдоалергічні, які реалізуються у вигляді шкірного свербіння, кропив’янки і виникають при прийомі ліків, що володіють властивостями лібераторів гістаміну або активаторів системи комплементу. Прикладами є морфін, тубокурарин, йодовмістні рентгеноконтрастні препарати, ампіцилін, ванкоміцин. Особливість механізму псевдоалергічних реакцій полягає в тому, що вивільнення гістаміну з тучних клітин зумовлене не сенсибілізацією та участю імуноглобулінів, як при алергії, а активацією системи комплементу або безпосереднім вивільненням медіаторів гіперчутливості негайного типу за рахунок біохімічних реакцій. Не потребуючи сенсибілізації, псевдоалергічні реакції виникають вже при першому введенні ЛП, що володіє відповідними властивостями. Псевдоалергічні реакції на ампіцилін особливо вірогідні у дітей, хворих на інфекційний мононуклеоз або цитомегаловірусну інфекцію, проявляються плямистим (рідше папульозним) висипом на внутрішній поверхні кінцівок, який зазвичай зникає самостійно протягом декількох днів, незважаючи на подальше застосування препарату. Клінічно відрізнити псевдоалергічні реакції від алергічних дуже важко. При їх появі доцільно припинити застосування ліків та використати антигістамінні препарати. Головну та П.д.л. необхідно розглядати в контексті тієї патології, для лікування якої призначені ЛП. Напр., головна дія атропіну, що застосовується при синусовій брадикардії, полягає в прискоренні серцевого ритму, а П.д.л. може виявлятися у вигляді непотрібного в даному випадку пригнічення шлункової секреції. Але у хворого на гастрит з підвищеною секреторною функцією головним стає антисекреторний ефект, а тахікардія — побічним. Причини та чинники виникнення П.д.л. можуть бути пов’язані з віком (у дітей до 1 року і в похилому віці ризик зазвичай підвищується), статтю (у жінок відмічають частіше), генетичними особливостями пацієнта (див. Ідіосинкразія, Фармакогенетика). Серед чинників, що сприяють проявам П.д.л., необхідно відзначити стан здоров’я. Зокрема, у хворих на бронхіальну астму висока реактивність бронхів провокує легке виявлення відомого побічного ефекту блокаторів β-адренорецепторів — бронхоспазму. При подагрі гідрохлоротіазид і фуросемід значно частіше викликають підвищення рівня сечової кислоти в крові, ніж за відсутності цієї фонової патології. Дуже велике значення має стан органів елімінації ксенобіотиків, насамперед, печінки та нирок. При недостатності їх функції значна кількість ліків протипоказана або потребує особливого режиму дозування. П.д.л. може посилюватися при їх використанні на тлі шкідливих звичок — куріння або вживання алкоголю. Зокрема, пероральні контрацептиви несумісні з курінням унаслідок підвищеного ризику тромбозу судин головного мозку і серця. Алкоголь різко підсилює пригнічення ЦНС клофеліном, нейролептиками, бензодіазепіновими транквілізаторами, барбітуратами та іншими депримуючими препаратами, збільшує гепатотоксичність парацетамолу.
Має значення також їжа. Вона може впливати на фармакокінетику або на фармакодинаміку багатьох ЛП і таким чином провокувати П.д.л. Так, грейпфрут або його сік сприяє порушенню метаболізму астемізолу, ніфедипіну, циклоспорину та інших ЛП, тому значно збільшує вірогідність П.д.л. з боку серцевого ритму. Низьке споживання кухонної солі уповільнює виведення бромідів, що створює умови для прояву їх П.д.л. Їжа та напої, багаті на тирамін (сир, копчене м’ясо чи риба, банани, пиво та ін.), сприяють значному підвищенню концентрації моноамінів у головному мозку під час дії антидепресантів групи інгібіторів МАО, тому можливий «сирний синдром» — гіпертонічний криз, судоми. Прикладів небезпечного поєднання ліків та їжі багато (див. Взаємодія лікарських речовин та їжі). Відомі приклади виявлення П.д.л., коли пацієнт після застосування певного препарату переходить на вживання іншого, що містить ту саму активну речовину в однаковій дозі, але випускається іншим виробником — так звані багатоджерельні ЛП (див. Генерична заміна). Найчастіше це спостерігається при лікуванні протиепілептичними препаратами, блокаторами β-адренорецепторів, блокаторами кальцієвих каналів. Причини прояву П.д.л. у подібних випадках можуть бути пов’язані з різницею біодоступності та інших фармакокінетичних параметрів, якістю субстанції, ефектами допоміжних речовин. Вірогідність П.д.л. збільшується при тривалому лікуванні: тривале використання антибіотиків значно підвищує ризик дисбіозу та інших побічних ефектів, НПЗП при захворюваннях суглобів, гіпоглікемічні препарати при цукровому діабеті та ін. При туберкульозі велике значення має гепатотоксичність більшості препаратів, що застосовуються в комбінації протягом кількох місяців (особливо піразинамід, ізоніазид, рифампіцин); при розвитку гепатиту прийом протитуберкульозних ЛП треба припинити, що інколи загрожує смертю тяжкохворого і потребує призначення найменш гепатотоксичних стрептоміцину та етамбутолу.
Чинником розвитку П.д.л. може бути шлях і швидкість введення ЛП, зокрема, у випадках швидкого створення високої концентрації ЛЗ в крові — при в/в введенні, коли біодоступність становить 100%. Завдяки здатності вивільняти гістамін при швидкому в/в введенні глікопептидний антибіотик ванкоміцин викликає небезпечний синдром «червоної людини» — почервоніння обличчя та верхньої половини тіла зі зниженням АТ, тахікардією, болем за грудниною, тому його інфузію треба робити повільно крапельно — протягом щонайменше 60 хв. Побічні ефекти можуть виникати і посилюватися при невдалому поєднанні ліків у разі їх несумісності. В організмі вона реалізується завдяки фармакокінетичній або фармакодинамічній взаємодії (див. Взаємодія ліків). Напр. надмірна брадикардія, порушення провідності серця, зниження його скоротливості можливі при одночасному застосуванні блокатора кальцієвих каналів верапамілу та блокаторів β-адренорецепторів (усі вони пригнічують роботу серця та його провідну систему), особливо при парентеральному введенні. В цьому разі побічні ефекти взаємно посилюються, потенціюються. У разі поєднання блокаторів β-адренорецепторів і дигідропіридинових блокаторів кальцієвих каналів, таких як ніфедипін, амлодипін, лацидипін та ін., що більше впливають на судини й менше — на серце, ризик цих проявів П.д.л. практично відсутній. Силденафіл (віагра) особливо легко викликає серцево-судинні ускладнення (колапс, серцева недостатність) при поєднанні з нітратами, оскільки обидва препарати підвищують рівень NO в організмі, тому їх сумісне застосування загрожує потенціюванням нітроксидергічних ефектів. Комбінація протигрибкових препаратів з групи азолів (кетоконазол, ітраконазол та ін.) і протиалергічних препаратів з групи блокаторів Н1-гістамінорецепторів ІІ покоління (астемізол, кларитин та ін.) надзвичайно небезпечна у зв’язку з підвищеним ризиком порушень серцевого ритму. НПЗП сприяють зменшенню вираженості сечогінної дії та підвищенню нефротоксичності діуретиків. Левоміцетин вкрай небезпечно використовувати на фоні або після прийому цитостатиків чи променевої терапії через збільшення ризику пригнічення кісткового мозку і функціонального стану печінки. У будь-якому випадку доцільно утримуватися від поліпрагмазії, яка значно збільшує вірогідність П.д.л. Варто уваги, що ще в 1853 р. професор Горянінов писав про «те правило фармакології, що слід знати багато, вживати якомога менше». Для зниження ризику П.д.л. використовують комбіновані препарати, що містять коригуючий компонент (петльові або тіазидні діуретики з калійзберігаючими — фурезис, тріампур, модуретик; тетрациклін у поєднанні з ністатином), що особливо зручно з точки зору комплаєнсу, або призначають коректори окремо (мізопростол для зменшення подразнення шлунка НПЗП, циклодол для зниження ризику паркінсонізму при лікуванні типовими нейролептиками — аміназином, галоперидолом та ін.; піридоксин разом з ізоніазидом для зменшення нейротоксичності). ДД та фітопрепарати, про вживання яких пацієнт часто не повідомляє лікаря, також можуть викликати побічні ефекти, до того ж вони здатні вступати у взаємодію з ліками та сприяти розвитку П.д.л. Напр., добавки, що містять гінкго або часник, збільшують ризик кровотечі під час використання ацетилсаліцилової кислоти та інших препаратів, що зменшують здатність до тромбоутворення. П.д.л. є одним з чинників, що впливає на комплаєнс: якщо ЛП викликає побічні ефекти, пацієнт може відмовитись від його вживання (див. Комплаєнс). П.д.л. необхідно відрізняти від ефектів, що спостерігаються при передозуванні. У дозах, що перевищують терапевтичні, ліки викликають токсичні ефекти, прояви яких з урахуванням спільності механізмів розвитку нерідко нагадують П.д.л., але виражені більше, тобто відмінності мають кількісний характер. Напр., передозування блокаторів β-адренорецепторів у зв’язку з різким ослабленням симпатоадреналових і переважанням парасимпатичних впливів на провідну систему супроводжується значними порушеннями провідності серця аж до повної атріовентрикулярної блокади, тоді як в діапазоні терапевтичних доз ці препарати лише трохи уповільнюють передсердно-шлуночкову провідність. Інсулін у високих дозах викликає значно глибшу, ніж в терапевтичних, гіпоглікемію й нейроглікопенію з розвитком коматозного стану. Цей вияв токсичної дії використовується для лікування шизофренії у разі стійкості до дії нейролептиків. Іноді токсичні ефекти якісно відрізняються від П.д.л. У терапевтичних дозах саліцилати можуть викликати компенсований респіраторний алкалоз у зв’язку з прямим збудженням дихального центру і підвищеним утворенням СО2 у тканинах. Але при передозуванні саліцилатів можливий розвиток метаболічного ацидозу, а також нетипове для терапевтичних доз підвищення температури тіла.
Деякі держави відносять питання безпеки ліків і ДД, які тісно пов’язані з П.д.л., до проблем національної безпеки. В Україні з 1995 р. вивченням П.д.л. займається Фармакологічний комітет (з 1999 р. — відділ фармакологічного нагляду Державного фармакологічного центру, нині — Державний експертний центр (див. Фармаконагляд) МОЗ). Діє наказ МОЗ України від 27.12.2006 р. № 898, що затверджує порядок здійснення нагляду за побічними реакціями на ЛП. Для виявлення побічних ефектів у всіх країнах світу, зокрема, в Україні, основне значення має метод спонтанних повідомлень, що відповідає вимогам закону України від 04.04.1996 р. № 123/96-ВР «Про лікарські засоби». Медичні працівники всіх спеціальностей добровільно інформують відповідні контролюючі органи — регіональні та національний центри служби контролю безпеки ліків (фармакологічного нагляду). Фармакологічний нагляд — це державна система збирання, наукової оцінки та контролю інформації про П.д.л. в умовах їх звичайного застосування з метою прийняття відповідних регуляторних рішень щодо зареєстрованих у державі ЛП. Подібні рішення можуть бути прийнятими на етапі клінічних випробувань ЛП. Метод спонтанних повідомлень особливо ефективний у виявленні П.д.л., зумовленої фармакологічними властивостями (механізмом дії) препаратів і імунноалергічними механізмами. Існує спеціальна форма карти-повідомлення, що містить інформацію про пацієнта, опис П.д.л. (час настання, ЛП, які зстосовували, результати обстеження, заходи корекції, наслідки). Лікувальні заклади щорічно подають загальний звіт про П.д.л. Такі відстрочені вияви побічної дії, як гепатит, ретиніт та ін., репродуктивні дефекти, мутагенні, тератогенні, канцерогенні ефекти, що виникають іноді через місяці або роки після лікування, особливо складні для виявлення та вивчення. Проблема П.д.л. є надзвичайно непростою. Через множинність механізмів і виявів П.д.л. існують певні труднощі її класифікації, виявлення, попередження. Неоднозначними є навіть питання термінології. Напр., у науковій і довідковій літературі, нормативних документах нерідко пропонується розрізняти П.д.л. та побічні реакції, хоча критерії кожного з цих явищ не є чіткими, а клінічні прояви та заходи корекції фактично збігаються. Інколи побічні ефекти є незвичайними та несподіваними, тому важко підозрювати їх зв’язок із застосуванням ЛП. П.д.л. може нагадувати спонтанне захворювання або виникати через тривалий час після застосування ліків, а клінічна картина хвороби може бути дуже складною та маскувати П.д.л. Подальший розвиток медицини і фармації, безумовно, сприятиме вдосконаленню знань про П.д.л.
Для зменшення П.д.л. необхідні постійне підвищення кваліфікації медичного та фармацевтичного персоналу, раціональне використання існуючих препаратів, уникнення поліпрагмазії, суворе урахування протипоказань, санітарна освіта та усвідомлення небезпеки самолікування широкими верствами населення, створення та впровадження більш безпечних нових ліків, особливо таких, що мають селективну дію. У запобіганні П.д.л. особливо великою є роль фармацевтичних працівників. Під час відпуску пацієнтові як безрецептурних, так і рецептурних препаратів фармацевт виступає в ролі консультанта, тому повинен добре орієнтуватися в питаннях П.д.л. і сумісності ЛП. Будь-які заходи щодо своєчасної профілактики, виявлення та корекції П.д.л. є необхідними та становлять основу підвищення безпеки фармакотерапії.
Астахова А.В., Лепахин В.К. Неблагоприятные побочные реакции и контроль безопасности лекарств: Руководство по фармаконадзору. — М. 2004; Астахова А.В., Лепахин В.К., Брайцева Е.В. Методы выявления неблагоприятных побочных реакций лекарств // Безопасность лекарств. — 2000. — № 2; Безопасность лекарств. Руководство по фармаконадзору / Под ред. А.П. Виторова, В.И. Мальцева, Ю.Б. Белоусова. — К., 2000; Взаимодействие лекарств и эфективность фармакотерапии / Л.В. Деримедведь, И.М. Перцев, Е.В. Шуванова и др. — Х., 2002; Горяниновъ П. Фармакодинамика или ученіе о действіи и употребленіи врачебныхъ средствъ. — СПб., 1853; Гусель В.А., Маркова И.В. Справочник педиатра по клинической фармакологии. — Л., 1989; Доклінічні дослідження лікарських засобів / За ред. О.В. Стефанова. — К., 2001; Кирющенков А.П., Тараховский М.Л. Влияние лекарственных средств, алкоголя и никотина на плод. — М., 1990; Маринчева Г.С., Коновалов В.В., Куприянова Т.А. Фетальный алкогольный синдром у детей (диагностика и клиническая картина). — М., 2000; Маркова И.В. Нежелательное действие лекарств на эмбрион, плод и новорожденного // Фармакол. и токсикол. — 1990. — № 4; Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. — М., 2000; Харкевич Д.А. Фармакология. — М., 2001; Штрыголь С.Ю., Гришина Т.Р. Фармакология с клинической фармакологией. — Иваново, 2002; Textbook of adverse drug reactions / D.M. Davie, ed. — Oxford: Oxford University Press, 1991; Monitoring of drug safety / W.H.W. Inmann ed. — Lancaster: MTP Press, 1986.