Каталіз (грец. catalysis — руйнування) — зміна швидкості хімічної реакції під впливом каталізаторів. Каталізатор — речовина, яка багаторазово вступає в проміжну хімічну взаємодію з реагентами та регенерується в кінці реакції. Каталізатор не впливає на загальну стехіометрію реакції, він зменшує енергію активації реакції, в результаті чого збільшується її швидкість. Каталізатор не впливає на константу рівноваги, однаковою мірою збільшуючи швидкість як прямої, так і зворотної реакції. К. позитивний — якщо в присутності каталізатора швидкість реакції збільшується, у протилежному випадку К. — негативний. До каталізаторів ставиться низка вимог: постійна каталітична активність, селективність, механічна міцність, термостійкість, стійкість до дії каталітичних отрут, легка регенерація, незначна вартість. Інколи застосовують суміш каталізаторів, активність яких адитивно підвищується, при додаванні промоторів (активаторів) — речовин, що самі по собі не мають каталітичної активності. Зниження активності каталізатора чи повне її припинення відбувається під дією каталітичних отрут — речовин, які адсорбуються на активних центрах каталізатора, призводячи до його отруєння. Отруєння може бути оборотним (після припинення подачі отрути активність відновлюється) і необоротним (коли для відновлення каталітичної активності необхідна регенерація каталізатора). Для подовження терміну служби каталізатора проводять ретельне очищення реагуючих речовин від домішок, що є каталітичними отрутами. У деяких випадках каталітичні отрути в малих кількостях можуть служити промоторами. Цей вид дії малих кількостей на активність каталізатора називається модифікуванням. Напр., аніон AsO33– у малих кількостях активує платину в реакції гідрування коричної кислоти, а у великих кількостях отруює її. Каталітичні отрути можуть діяти вибірково, тобто пригнічувати одну реакцію і бути каталізатором для іншої. Напр., кисень отруює залізні каталізатори синтезу аміаку, але активує платинові каталізатори окиснення водню.
Одним з різновидів каталізу є автокаталіз — процес, в якому прискорення певної хімічної чи біологічної реакції здійснюється одним з її продуктів. Напр., гідроліз амілацетату у розчині прискорюється іонами гідрогену:
СН3СООС5Н11 + Н2О ↔ СН3СООН + С5Н11ОН
СН3СООН ↔ СН3СОО— + Н+.
Перебіг автокаталітичних реакцій відбувається з постійно зростаючою швидкістю. Механізм каталітичних реакцій різноманітний і лише у деяких випадках більш-менш з’ясований. Розрізняють гомогенний К., коли каталізатор і реагент знаходяться в одній фазі, та гетерогенний К., коли каталізатор і реагуючі речовини утворюють різні фази. У разі гетерогенно-гомогенного каталізу реакція починається на поверхні твердого каталізатора, а потім продовжується в об’ємі. Міжфазний К. проходить на межі поділу двох рідин, що не змішуються, а каталізатор при цьому переносить реагент між фазами. Мікрогетерогенний К. займає проміжне положення між гомогенним і гетерогенним, каталізатор у цьому разі перебуває в колоїдному чи у високомолекулярному стані.
Каталіз широко застосовується у промисловому одержанні лікарських речовин, таких, як амінолон, кислота амінокапронова, фенібут, кислота глютамінова, цистеїн, ацетилцистеїн, метіонін. У медичній практиці застосовують розчин формальдегіду (формалін) і хлоралгідрат. При одержанні формальдегіду як каталізатори застосовують мідь, срібло, кокс. Вихідною речовиною для одержання хлоралгідрату є хлораль — один із проміжних продуктів синтезу хлороформу. Синтезують хлораль з етилового спирту в присутності каталізатора — солей заліза (ІІІ). Каталіз відіграє значну роль у природі. Складні комплекси хімічних перетворень в організмах, які зумовлюють шумування, дихання, травлення, синтез білків тощо, перетворення хімічної енергії в механічну здійснюється за допомогою ферментів, що перевершують за деякими властивостями промислові каталізатори. Багато патологічних явищ зумовлено порушенням погодженої дії ферментів, які відповідають за нормальний хід процесів життєдіяльності. Останнім часом широко ведуться дослідження синтетичних органічних каталізаторів — органічних напівпровідників, комплексних сполук, клішнеподібних полімерів, які характеризуються більш простим складом і будовою порівняно з ферментами, але здатні моделювати певною мірою їх дію.
Важливу роль у процесах, що відбуваються в живих організмах у нормі, а також при патології, відіграє автокаталіз. Такі реакції спостерігаються при різних патологіях, які супроводжуються руйнуванням біологічних структур.
Каталіз гомогенний — різновид К., коли каталізатор і реагенти утворюють одну фазу. Механізм К. гомогенного пояснюється теорією проміжних сполук. Відповідно до цієї теорії каталізатор утворює з однією з реагуючих речовин нестійку проміжну сполуку, що надалі взаємодіє з іншими реагентами, напр., у присутності каталізатора реакція А + В ↔ АВ відбувається у дві стадії:
А + K 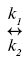 AK
AK
AK + B 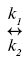 AB + K.
AB + K.
Енергетичні бар’єри, які необхідно подолати на кожній з цих стадій, значно нижчі, ніж для некаталітичного процесу, тому вони відбуваються з більшою швидкістю, ніж некаталітична реакція. Швидкість гомогенної каталітичної реакції найчастіше пропорційна концентрації каталізатора. Проміжна сполука АK (інтермедіат) перебуває в рівновазі з вихідними речовинами, отже, швидкість прямої (υ1) і зворотної (υ2) реакції дорівнює:
k1 ‧ c´A(cK — c´AK) = k2 ‧ c´AK,
де cК — c´AK; c´A; c´AK — рівноважні концентрації каталізатора, речовини А і проміжної сполуки АK відповідно. Сумарна швидкість усього процесу u визначається швидкістю повільної другої стадії:
υ = k3 ‧ c´AK ‧ cB,
або
![]()
Існують різні типи К. гомогенного: кислотно-основний, координаційний, ферментативний та ін.
К. кислотно-основний полягає у протеолітичній взаємодії між каталізатором і реагуючою речовиною, внаслідок чого утворюється нестійка проміжна сполука, яка потім розкладається на продукт реакції і каталізатор. За класичною теорією К. кислотно-основний (В. Оствальд, С. Арреніус) каталітичну дію мають винятково іони водню і гідроксилу. Пізніше було встановлено, що реакції, які прискорюються іонами Н+ і ОН–, каталізуються також недисоційованими молекулами кислот і основ та різними іншими іонами. К. кислотно-основний включає: 1) специфічний К. кислотно-основний, при якому активація субстрату здійснюється іонами гідроксонію і гідроксилу; 2) загальний К. кислотно-основний з активацією субстрату, що відбувається під дією так званих узагальнених кислот і основ Бренстеда; 3) електрофільно-нуклеофільний каталіз, коли каталізаторами є кислоти і основи Льюїса.
Одним із різновидів К. гомогенного є координаційний К. У цьому разі каталізаторами є комплексні сполуки іонів металів (Fe, Co, Ni, Cu, Cr, Mn). Хімічна взаємодія між реагуючими молекулами, координованими біля центрального іону металу, полегшується завдяки поляризації молекул і зниженню енергії окремих зв’язків. Тобто центральний іон металу є містком, який полегшує електронні переходи між реагуючими молекулами.
К. кислотно-основний застосовується при гідратації та ізомеризації олефінів, етерифікації спиртів, нітруванні вуглеводнів, гідролізі крохмалю та інших полісахаридів, алкілуванні ароматичних сполук, каталітичному крекінгу нафти, синтезі високомолекулярних речовин методами іонної полімеризації тощо.
К. гетерогенний — різновид К., коли каталізатор і реагенти утворюють різні фази. Найчастіше каталізатор перебуває у твердому стані, а реагенти і продукти реакції в рідкому чи газоподібному.
Процес К. гетерогенного складається з п’яти стадій: дифузія вихідних речовин до поверхні каталізатора; адсорбція вихідних речовин на активних центрах за рахунок хімічних і електростатичних сил; взаємодія адсорбованих речовин з утворенням продуктів реакції; десорбція продуктів з поверхні; дифузія продуктів у глибину фази. Швидкість К. гетерогенного залежить від питомої поверхні каталізатора, тобто каталізатор повинен знаходитися у високодисперсному стані. К. гетерогенний тісно пов’язаний з адсорбцією (див. Адсорбція). Адсорбція реагуючої речовини на каталізаторі може здійснюватися за рахунок сил міжмолекулярної взаємодії (фізична адсорбція). При цьому адсорбовані молекули, особливо при наявності полярних груп, певним чином орієнтовані до поверхні. Необхідною стадією каталітичної реакції є хемосорбція хоча б одного з реагентів, коли між адсорбованою речовиною і каталізатором виникає хімічна взаємодія. Розрізняють кислотно-основний, окисно-відновний К. гетерогенний і К. на металах.
Кислотно-основний К. гетерогенний полягає у проміжній взаємодії кислотно-основного характеру між каталізатором та реагуючою речовиною. Як каталізатор можуть бути використані кислоти, нанесені на тверді носії або тверді основи. В окисно-відновних реакціях взаємодія реагуючих речовин з каталізатором зумовлена електронними переходами. Характер цієї взаємодії залежить від електронної структури твердого каталізатора.
Існує декілька теорій К. гетерогенного. Необхідною умовою гетерогенного каталітичного процесу є адсорбція хоча б однієї з реагуючих речовин. Спочатку припускали, що саме підвищення концентрації реагуючих речовин на поверхні каталізатора зумовлює каталітичну активність. Але швидкість реакції, як свідчить дослід, підвищується набагато більше, ніж концентрація реагуючих речовин на поверхні. Крім того, каталізатори з однаковою адсорбційною здатністю мають різну каталітичну активність. Отже, адсорбція не може бути достатньою умовою перебігу каталітичного процесу. Пізніше було доведено, що каталітичний процес відбувається лише при активованій адсорбції, тобто хемосорбції. Це твердження лежить в основі теорії проміжних поверхневих сполук, згідно з якою перебіг реакції відбувається через утворення проміжної поверхневої сполуки, що надалі розкладається з виділенням продукту реакції. Проміжна сполука повинна мати деяку оптимальну міцність, процеси її утворення і розкладання мають характеризуватися невисокими, за можливістю рівними, значеннями енергії активації. Теорія проміжних сполук дозволяє прогнозувати каталітичні властивості речовини. У реакціях окиснення активними каталізаторами, очевидно, повинні бути речовини, які можуть утворювати нестійкі сполуки з киснем, напр., оксиди металів зі змінною валентністю. Каталізатори реакції гідрування повинні давати нестійкі гідриди (напр. нікель, паладій). Подальший розвиток теорії проміжних поверхневих сполук полягав у вивченні природи активних центрів, на яких відбувається каталітичний процес.
Згідно з мультиплетною теорією К. (О.О. Баландін) активним центром є кілька сусідніх атомів поверхневого шару каталізатора, розташованих у вузлах його кристалічної решітки. Сукупність цих атомів називається мультиплетом. Молекула адсорбується різними частинами на різних атомах мультиплету, при цьому зв’язки в ній деформуються, утворюється хемосорбційний мультиплетний комплекс, який розкладається і дає продукти реакції:
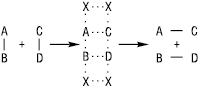
На схемі хрестиками позначені атоми мультиплету, а пунктиром — хімічні зв’язки, одні з яких ще не розірвалися, а інші — лише почали утворюватися. Відстань між сусідніми атомами у кристалічній решітці повинна відповідати довжині молекули реагуючої речовини (принцип геометричної відповідності). Оптимальна каталітична активність досягається, якщо енергії утворення і розкладання мультиплетного комплексу рівні. Дуже слабкі або дуже сильні взаємодії реагуючих речовин з каталізатором небажані. Практичне застосування мультиплетної теорії ускладнене у зв’язку з тим, що необхідно визначати енергію зв’язку атомів речовини з каталізатором.
Згідно з електронною теорією К. каталізатор містить вільні або слабко зв’язані електрони, які беруть участь у окисно-відновних процесах на поверхні поділу фаз. До таких каталізаторів належать метали та напівпровідники. Напр., кисень, віднімаючи вільний електрон у платини чи паладію на їх поверхні, утворює іон О–, метал заряджається позитивно і віднімає електрон у молекули водню, яка адсорбується. Мігруючи по поверхні, протилежно заряджені іони легко взаємодіють, у той час як безпосередня взаємодія між киснем і воднем відбувається дуже повільно. Сучасні теорії гетерогенного К. базуються на квантово-хімічних розрахунках структури і реакційної здатності поверхневих комплексів, а також експериментальному дослідженні кінетики окремих стадій гетерогенно-каталітичних реакцій.
к. ферментативний — К., що здійснюється за участю ферментів. Ферменти (ензими) — це глобулярні білки, які каталізують біохімічні реакції. У чистому вигляді один з ферментів вперше був одержаний Самнером у 1926 р. На сьогодні відомо понад 1500 ферментів.
У назві ферментів відображається їх функція, а не будова: до назви субстрату додають суфікс -аза (напр. уреаза — фермент, що каталізує розкладання сечовини). Іноді той же суфікс додають до назви реакції, яку каталізує певний фермент (алкогольдегідрогеназа каталізує окисне дегідрування спирту). Ферменти каталізують реакції 6 основних типів. Оксидоредуктази каталізують окисно-відновні реакції (діють на
| | | |
–CH–OH, –C=O, –CH=CH–,
| |
–CH–NH2, –CN–NH– групи);
трансферази — перенесення функціональних груп (переносять альдегідні та кетонні групи, ацильні, глікозильні, фосфатні групи та групи, що містять сірку); гідралази — реакції гідролізу (діють на складноефірні, глікозидні, пептидні, кислотноангідридні зв’язки та на С–N-зв’язки, що відрізняються від пептидних). Ліази каталізують приєднання за подвійними зв’язками:
| | | |
(–C=C–, –C=O, –C=N–);
ізомерази каталізують реакції ізомеризації (рацемази); лігази — утворення зв’язків, що супроводжуються розщепленням АТФ (утворюють С–О; С–S; С–N; С–С-зв’язки). Щоб точно визначити, про який фермент йдеться, вказують його походження, тому що ферменти з однаковою назвою, але виділені з різних організмів, часто мають різні амінокислотні послідовності і тому відрізняються за властивостями та каталітичною активністю. Ферменти відрізняються від небіологічних каталізаторів високою активністю і особливо високою специфічністю.
Специфічність каталізаторів — здатність ферментів прискорювати реакцію лише між цілком певними речовинами, які називають субстратами, і відсутність ефекту щодо реакції між іншими молекулами. Специфічність ферментів зумовлена їх складною об’ємною структурою, яка дозволяє сформувати активний центр — суворо орієнтований у просторі ансамбль функціональних груп білка, які орієнтують молекули субстрату (реагуючої речовини) у певне положення. Активний центр схожий на матрицю, до якої може увійти лише молекула певної будови. Механізм К. ферментативного полягає в тому, що фермент (Е) і субстрат (S) реагують оборотно з утворенням комплексу (ЕS), який має більш високу реакційну здатність, ніж вихідний субстрат, і необоротно розкладається з утворенням продукту реакції (Р) і регенерацією вихідного ферменту:
E + S 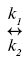 ES
ES 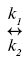 E + P.
E + P.
Існування фермент-субстратних комплексів доведене за допомогою рентгеноструктурного аналізу та електронного парамагнітного резонансу. Для деяких ферментів характерна наявність кофакторів, необхідних для прояву ферментативної активності. Кофактор — сполука небілкової природи, яка зв’язується з неактивним білком (апоферментом) з утворенням каталітично активного комплексу (голоферменту). Існують два типи кофакторів — іони металів (Са2+, Со2+, Сu2+, Fe2+, Fe3+, Mg2+, Mn2+, Na+, Zn2+) та складні органічні сполуки — коферменти (NAD, FAD, A(CoA)). Коферменти зв’язуються з ферментами слабкими зв’язками. При цьому існує рівновага між ферментом, апоферментом та кофактором. Ферменти як біологічні каталізатори недовговічні. Складна просторова структура ферментів, що зумовлює їх високу специфічність і активність (кількість молекул субстрату, які перетворилися під дією однієї молекули ферменту за 1 хв), легко руйнується, що і призводить до втрати ферментом його каталітичних властивостей. На ферментативну активність впливають модулятори (речовини, що можуть бути компонентами клітини чи проникають у клітину з середовища), рН, температура, гідродинамічні сили, тиск, поверхневий натяг, хімічні агенти, опромінювання.
Деякі процеси здійснюються за допомогою іммобілізованих ферментів. Іммобілізація — засіб закріплення ферментів на різних поверхнях, що забезпечує можливість їх використання у безперервних процесах. Іммобілізовані ферменти зберігають активність довше, їх можна локалізувати відповідно до послідовності каталітичних процесів. Ферментативний К. займає значне місце в життєдіяльності людини. Шумування, гліколіз, дихання, біосинтез амінокислот, цукрів, жирних кислот, білків, нуклеїнових кислот, ліпідів — усі ці процеси каталізуються ферментами. Патологічні явища здебільшого зумовлені порушенням погодженої дії ферментів.
У медичній практиці широко використовують ферментативні препарати: пепсин — при гастриті; лідазу — у разі гематом, рубців після опіків і операцій; препарати лізоциму — при інфекційних захворюваннях; стрептокіназу, стрептазу — для розчинення тромбів; цитохром — при хронічній коронарній недостатності та бронхіальній астмі; пеніциліназу — при гострих алергічних реакціях й анафілактичному шоку. Існує низка препаратів, до складу яких входять декілька ферментів (фестал, ензистал, мезим, солізим), призначених для комплексного лізису білків, вуглеводів і жирів. Поряд з ферментами як ЛП успішно використовують коферментні препарати (кокарбоксилазу, рибофлавіну мононуклеотид, флавініт, піридоксальфосфат, кобамід). Одночасно розширюється коло ЛП, дія яких пов’язана з інактивацією ферментів: пантрипін, ігітрил та інші застосовують для лікування гострих панкреатитів; інгібітори фібринолізу (зокрема амінокапронові кислоти) — як антигеморагічні засоби; інгібітори карбоангідрази — як діуретичні засоби. Ефективність алопуринолу при гіперурикемії пов’язана з інгібуванням ним ферменту ксантинооксидази, застосування тетураму — з пригніченням ферменту ацетальдегідроксидази. Початкові стадії деяких захворювань, а також внутрішні травми супроводжуються зниженням або підвищенням концентрації деяких ферментів у таких рідинах організму, як кров або сеча. Ці дані можна використовувати як засоби діагностики при захворюваннях, пов’язаних з порушенням функцій серця, підшлункової залози, патологічними змінами у м’язовій та кістковій тканинах, а також із розвитком злоякісних пухлин.
Бейли Дж., Оллис Д. Основы биохимической инженерии: В 2 ч. — М., 1989. — Ч. 1; Березин И.В. Исследования в области ферментативного катализа и инженерной энзимологии. — М., 1990; Машковский М.Д. Лекарственные средства: В 2 т. — М., 2002. — Т. 2; Химическая энциклопедия: В 5 т. — М., 1990. — Т. 2; Чанг Р. Физическая химия с приложениями к биологическим системам / Под ред. Ю.И. Машковского. — М., 1980; Физическая химия: В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ / К.С. Краснов, Н.К. Воробьев, И.Н. Годнев и др. — М., 2001; Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін. — Х., 1999.
