ЗМОЧУВАННЯ — явище, що відбувається на межі розподілу 3 фаз, одна з яких обов’язково є рідкою. З. є результатом міжмолекулярної взаємодії. Мірою З. є кут, який нанесена крапля рідини у рівноважному стані утворює з твердою поверхнею або з поверхнею рідини, що з нею не змішується. Його визначають як кут між поверхнею твердого тіла (або рідини, що не змішується) і дотичною в точці стикання трьох фаз (рис. 1) і називають крайовим кутом, або кутом змочування (θ). Крайовий кут завжди вимірюють з боку рідини; він може змінюватись у межах від 0 до 180°. Величину соsθ, якою також характеризують здатність рідини змочувати поверхню, називають З. і позначають В.
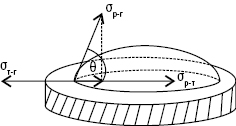
Рис. 1. Крайовий кут при рівноважному змочуванні
Стан рівноваги описує рівняння Юнга:
![]() , (1)
, (1)
де σр-г, σт-г, σр-т — поверхневі натяги відповідно на межі рідина — газ, тверде тіло — газ, рідина — тверде тіло.
Як критерій здатності рідин змочувати тверді тіла та розтікатись по поверхні іншої (твердої або рідкої) фази може служити також співвідношення між роботою когезії Wc, роботою адгезії Wa і З. cosθ (див. Адгезія, Когезія):
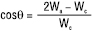 . (2)
. (2)
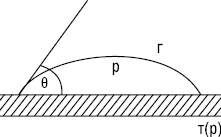
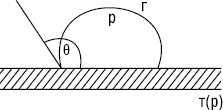
За умови Wa < 1/2Wc відзначають незмочування (ліофобність); 1/2Wc < Wa < Wc — З. (ліофільність); Wa > Wc — розтікання рідини по поверхні (рис. 2). Чим більша різниця між Wa і Wc, тим інтенсивнішими будуть розтікання і З.
а
б
Рис.2. Крайові кути змочування: а) ліофільна (гідрофільна) поверхня; б) ліофобна (гідрофобна) поверхня
Із рівняння (1) випливає, що процесом З. можна керувати, змінюючи міжфазні натяги у системі. Найефективнішим методом є додавання ПАР до рідкої фази або попередня обробка твердої поверхні розчинами ПАР (див. Поверхнево-активні речовини). Завдяки присутності ПАР можна гідрофілізувати гідрофобні поверхні, тобто викликати їх З. водою та іншими полярними рідинами або надати гідрофобних властивостей гідрофільній поверхні. Це явище називається інверсією З. Його механізм пояснюється певною орієнтацією молекул ПАР в адсорбційному шарі. Напр., якщо тверда поверхня була спочатку гідрофільною, то адсорбовані молекули взаємодіють з нею своїми полярними групами, а неполярні ланцюги обертаються назовні, внаслідок чого ця поверхня стає гідрофобною. Якщо тверда поверхня гідрофобна, адсорбовані на ній молекули ПАР обертаються до неї своїми вуглеводневими ланцюгами, а полярними групами — назовні, внаслідок поверхня стає гідрофільною.
У тих випадках, коли неможливо експериментально визначити θ, напр., при З. рідиною порошків, критерієм З. може бути теплота З. Для оцінки гідрофільності порошкоподібних тіл П.О. Ребіндер запропонував використовувати відношення теплоти З. їх водою q1 до теплоти З. бензолом (або гексаном) q2: β = q1/q2, де β — коефіцієнт гідрофільності. Для гідрофільної поверхні β >1, для гідрофобної — β <1.
Для запобігання відволожуванню гігроскопічних порошків застосовують інверсію З. Додавання ПАР сприяє утворенню захисної плівки на частинках порошку, яка зменшує його взаємодію з водяною парою.
Оскільки З. є першою стадією фізико-хімічної взаємодії рідини з твердим тілом (або рідиною, що не змішується), визначення кута З. або теплоти З. поверхні полярними та неполярними розчинниками дає змогу оцінити її гідрофільність та вибрати оптимальні умови екстрагування, розчинення, флотації, подрібнення в технології виробництва фармацевтичної продукції та парфумерно-косметичних виробів.
Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. — М., 1990; Основи колоїдної хімії: фізико-хімія поверхневих явищ і дисперсних систем / М.О. Мчедлов-Петросян, В.І. Лебідь, О.М. Глазкова та ін. — Х., 2004; Ребиндер П.А. Поверхностные явления в дисперсных системах. Коллоидная химия. — М., 1978.
