ПОВЕРХНЕВИЙ НАТЯГ (МІЖФАЗНИЙ НАТЯГ) — найважливіша термодинамічна характеристика поверхні поділу фаз (тіл), яка визначається міжмолекулярними взаємодіями та структурою поверхневого шару. Термодинамічно П.н. (σ) визначають як роботу (W) оборотного ізотермічного утворення одиниці площі нової поверхні шляхом розтягнення старої. П.н. поверхні рідини правомірно також розглядати як силу, що діє на одиницю довжини контура, який обмежує поверхню поділу фаз, спрямовану тангенціально до поверхні та прагне скоротити її до мінімуму при заданих об’ємах фаз (рис. 1).
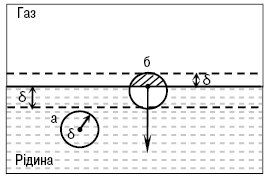
Рис. 1. Модель геометричної поверхні поділу рідина газ (δ ~10-9): а — молекула в об’ємі рідини; б — молекула поблизу поверхні
Робота утворення нової поверхні витрачається на подолання сил міжмолекулярного зчеплення (когезії) (див. Когезія) під час переходу молекул речовини з об’єму тіла у поверхневий шар. Рівнодіюча міжмолекулярних сил у поверхневому шарі не дорівнює нулю (як в об’ємі рідини) та спрямована всередину фази з більшою когезією. Отже, П.н. є мірою некомпенсованості міжмолекулярних сил у поверхневому (міжфазному) шарі або, що те саме, є фактором інтенсивності поверхневої енергії. Надлишкова вільна енергія поверхні, яка виникла в ізобарно-ізотермічних умовах, становить:
ΔGs= –W = σ·s,
де s — площа поверхні; σ — П.н. Верхній індекс «s» означає, що цей параметр характеризує поверхню.
Оскільки П.н. вимірюється на межі поділу двох фаз, то його позначають σА/В, де А і В — фази, що межують. Якщо одна із фаз — повітря, газ або пара, то вона зазвичай не позначається σА. Відповідно до визначень П.н. у СІ його виражають в Дж/м2 або Н/м. Напр., значення П.н. води становить 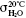 =72,75·10–3 Дж/м2. Міжфазний натяг на межі двох рідин, які не змішуються, може бути розрахований за правилом Антонова:
=72,75·10–3 Дж/м2. Міжфазний натяг на межі двох рідин, які не змішуються, може бути розрахований за правилом Антонова:
σАB = σА — σB,
де σАB — міжфазний натяг на межі поділу між взаємнонасиченими рідинами; σА — П.н. на межі з газом (повітрям) насиченого розчину рідини 2 у рідині 1; σB — П.н. на межі з газом (повітрям) насиченого розчину рідини 1 у рідині 2.
П.н. твердих та рідких тіл залежить від температури (рис. 2). З підвищенням температури П.н. зменшується, оскільки послаблюється когезія. Як показав Д.І. Менделєєв, при достатньо низькій критичній температурі П.н. дорівнюватиме нулю. Залежність П.н. від абсолютної температури має вигляд:
σТ = β (Ткр — Δ — Т) σ0,
де β — коефіцієнт пропорційності; Δ — поправка (6°); Ткр та Т — критична температура та температура досліду відповідно; σ0 — П.н. при початковій температурі; σТ — П.н. при температурі досліду.
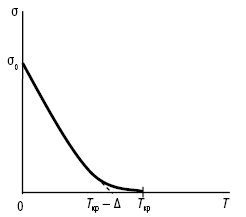
Рис. 2. Залежність П.н. σ від температури Т
П.н. розчину залежить також від природи розчинника та розчиненої речовини. Додавання до чистого розчинника будь-якої речовини може значно вплинути на П.н. розчинника. Якщо речовина знижує П.н. розчинника, її називають поверхнево-активною (ПАР), якщо підвищує — поверхнево-неактивною (ПНАР) (див. Поверхнево-активні речовини). Графічна залежність σ = f (c) називається ізотермою П.н. (рис. 3). Для ПАР і ПНАР ізотерми σ = f (c) наведені на рис. 3 (криві 1 і 2 відповідно). Для індиферентних речовин ізотерма представляє собою пряму, яка паралельна осі абсцис (див. рис. 3, крива 3). З підвищенням концентрації розчинів ПАР зниження П.н. підпорядковується емпіричному рівнянню Шишковського (див. Шишковського рівняння). Методи вимірювання П.н. на рідких (рухливих) поверхнях поділу фаз умовно поділяють на три групи: 1) статичні (методи капілярного підняття і лежачої або висячої краплі); 2) напівстатичні (методи максимального тиску бульбашки (краплі), відриву кільця, відриву пластинки, зважування або рахування крапель); 3) динамічні (методи капілярних хвиль, струменів, що коливаються). Найбільш точні результати дають статичні методи, які базуються на вивченні нерухомих менісків рідини або профілю крапель і бульбашок. У цих випадках поверхня рідини знаходиться в рівновазі з її об’ємом і не змінюється під час вимірювань. Динамічні методи застосовують, коли передбачається швидке встановлення рівноваги між поверхневим шаром і об’ємом рідини. Для визначення П.н. на межі рідина — рідина, рідина — газ або рідина — пара застосовують методи капілярного підняття, зважування або рахування крапель, максимального тиску бульбашок, відриву кільця і деякі інші методи. Для вимірювання П.н. твердих тіл використовують лише непрямі методи його визначення, напр. метод розчинності (див. Розчинність), що ґрунтується на законі В. Томпсона (Кельвіна), який пов’язує розчинність речовини з розміром його малих частинок і П.н. Слід зазначити, що П.н. кристалів носить усереднений характер, оскільки залежно від щільності заповнення граней кристалу атомами або іонами інтенсивність дії молекулярних сил, яка відповідає різним граням кристалу, неоднакова, а отже їм відповідає різний П.н.
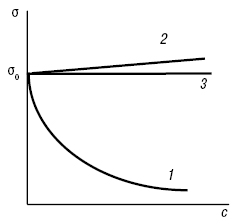
Рис. 3. Залежність П.н. σ від концентрації с розчиненої речовини
П.н. є важливою молекулярною сталою твердих і рідких тіл (при Т=const). Зокрема, разом із такими параметрами, як дипольний момент μ, поляризовність α та діелектрична проникність ε, П.н. характеризує інтенсивність поля молекулярних сил, яка позначається загальним терміном полярність рідини. П.н. є важливою фізико-хімічною характеристикою ЛП у вигляді рідини, знання якої необхідно під час розробки їх технології, вивчення стабільності та встановлення термінів придатності. У живих організмах П.н. клітини — один із факторів, який визначає форму клітини та її окремих частин. Для клітин, що мають жорстку або напівжорстку поверхню (деякі мікроорганізми, інфузорії, клітини рослин тощо), значення П.н. відносно невелике. Локальні зміни П.н. важливі в таких явищах, як фагоцитоз, піноцитоз, гаструляція.
Воюцкий С.С. Курс коллоидной химии. — М., 1976; Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. — М., 1990; Красовский И.В., Вайль Е.И., Безуглый В.Д. Физическая и коллоидная химия. — К., 1983; Пасынский А.Г. Биофизическая химия. — М., 1968; Ребиндер П.А. Поверхностные явления в дисперсных системах. Коллоидная химия: Избр. тр. — М., 1978; Фізична та колоїдна хімія / В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін. — Х., 1999; Фролов Ю.Г. Курс коллоидной химии: Поверхностные явления и дисперсные системы. — М., 2004; Химическая энциклопедия. — М., 1990.
