КАЛІЙ ГІДРОГЕНПЕРОКСОМОНОСУЛЬФАТ, КHSO5 (син. Monopotassium persulfate; Potassium hydrogen peroxomonosulfate; Monopotassium peroxymonosulfate, однозаміщена калійна сіль пероксомоносульфатної кислоти — кислоти Каро) за своєю будовою відповідає монозаміщеній калійній солі сульфатної кислоти, в якій одна ОН-група заміщена на ООН-групу: НО–О–S(O)2–OK (молярна маса — 152,16 г/моль). Наслідком такого заміщення є те, що К.г. (КHSO5) стає більш енергійним окисником, ніж H2O2та H2S2O8. К.г. можна розглядати також і як похідне гідроген пероксиду, але, на відміну від нього, не реагує з кислими розчинами калій перманганату і Ti (IV) та здатний швидко окиснювати йодид-іони до вільного йоду; кетони окиснюються до лактонів (реакція Бай’єра — Вілігера), бензальдоксим — до бензилгідроксимової кислоти, органічні сульфіди — до сульфоксидів, а отже, — до сульфонів, а піридин — до N-оксиду піридину тощо.
К.г. доступний як хімічний реагент, що випускають у формі стійкої потрійної калійної солі 2КНSO5∙КНSO4∙K2SO4 квалiфiкацiї «extra pure», що добувають шляхом нейтралізації сульфатнокислого розчину кислоти Каро (див. Кислота Каро) поташом до рН 2. Вона у твердому стані є досить стійкою, навіть при кімнатній температурі. Комерційний препарат містить незначні домішки K2S2O8, водні розчини не містять H2O2. Незначні забруднення H2O2 наявні, коли кислота Каро синтезована з концентрованих розчинів H2О2 (>50%) та H2SO4 (>85%) H2O2 і хлорсульфонової кислоти або розкладанням K2S2O8 у сильнокислому середовищі (див. Кислота Каро).
Pентгеноструктурним аналізом при низькій температурі підтверджено існування короткого і несиметричного О–О-зв’язку (1,463 Å порівнянні із 1,453 Å у Н2О2 та 1,497 Å у S2O82–) з атомами гідрогену з одного боку та SO3–-групи — з іншого:
HO–O–S(O)2–O–.
Спонтанне (самовільне) розкладання К.г. у воді не супроводжується утворенням вільних радикалів. Найвища швидкість розкладення К.г. досягається при рН, що відповідає рКа2 кислоти Каро. У перехідному стані проміжного комплексу беруть участь одночасно моно- та діаніон пероксомоносульфатної кислоти, внаслідок розпаду якого утворюється сульфат-діаніон та кисень. Іонний механізм розкладання пероксомоносульфатної кислоти у водному розчині може бути зображений схемою:
HSO5– + SO52– → [HSO62–] + SO42– →
2 SO42– + O2 + H2O.
Цей механізм розкладення К.г. був доведений методом маркованих атомів. Під час формування проміжного комплексу перехідного стану в основному реалізується нуклеофільна атака діаніону на атом Оксигену пероксоугруповання моноаніону гідрогенпероксомоносульфату (до 90%), що зумовлено просторовою недоступністю атома Сульфуру. Схема утворення перехідного комплексу під час розкладання пероксомоносульфату у водних лужних розчинах, а також механізм утворення кисню внаслідок розкладання активованого комплексу перехідного стану (А) можуть бути подані таким чином:
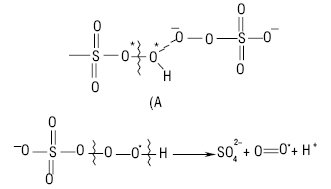
У водних розчинах за наявності солей перехідних металів спостерігається каталітичне розкладення пероксомоносульфату з виділенням кисню. Іони Fe(II) та V(IV) окиснюються К.г. за механізмом одноелектронного перенесення з утворенням аніон-радикалів сульфату як інтермедіатів. Процес окиснення аніонів — формально двоелектронний, який містить перенесення атомів Оксигену.
Механізм взаємодії іонів феруму(ІІ) з гідрогенпероксомоносульфатом наведений на схемі.
2Fe2+ + НSO5– + 2H+ = 2Fe3+ + НSO4– + H2O,
Fe3+ + НSO4– = FeSO4+ + H+.
Розбавлені лужні водні розчини К.г. повільно розкладаються з виділенням гідроген пероксиду, що обмежує термін їхнього використання до кількох тижнів.
КНSO5 + H2O = К2SO4 + H2O2.
Стандартний окисно-відновний потенціал системи гідрогенпероксомоносульфат/гідрогенсульфат становить +1,84 В (НВЕ), а системи SO52–/SO42– +1,22 В, що узгоджується з яскраво вираженими оксидаційними властивостями КHSO5, які спостерігаються на практиці під час окиснення органічних сульфідів та інших органічних сполук (амінів, кетонів, олефінів тощо).
К.г. є основним компонентом відомих дезінфекційних та стерилізуючих засобів нового покоління, а також входить до складу засобів очищення та гігієни зубних протезів, жіночих гігієнічних прокладок тощо, які знаходять широке застосування в медицині.
Дослідження стабільності розведених розчинів кислоти Каро // О.А. Пилипчук, В.К. Зінчук, Н.М. Сушинцева, В.О. Василечко // Укр. хім. журн. — 1996. — Т. 62. — № 2; Марч Дж. Органическая химия. Реакции, механизмы и структура. Углублённый курс для университетов и химических вузов: В 4 т. — Т. 4 / Пер. с англ. — М., 1988; Agrawal A. The Kinetics and Mechanism for the Oxidation of Nicotinic Acid by Peroxomonosulfate in Acidic Aqueous Medium / A. Agrawal, R. Sailani, B. Gupta // J. Corean Chem. Sci. — 2012. — V. 56. — № 2; Balakrishnan T. The kinetic and mechanism of induced thermal decomposition of peroxomonosulphate by phase tranfer catalysts / T. Balakrishnan, S.D. Kumar // Proc. Indian. Acad. Sci. (Chem Sci.). — 2000. — V. 112. — № 4; Koubek E. An isotope study of the decomposition of Caro’s acid / E. Koubek, G. Levey, J.O. Edwards // Inorg. Chem. — 1964. — V. 3. — № 9; Spiro M. The standard potential of the peroxosulphate / sulphate couple / M. Spiroa // Electrochem. Acta. — 1979. — V. 24; Schlemper E.O. Structure, deformation density and atomic charges in potassium hydrogenperoxomonosulfate monohydrate, KHSO5•H2O / E.O. Schlemper, R.C. Thompson, C.K. Fair, F.K. Ross, E.H. Appelman and L.J. Basile // Acta Cryst. — 1984. — V. 40, P. 11; The chemistry of peroxides / Ed. Z. Rappoport. — V. 2, P. I. — John Wiley & Sons, Ltd., 2006.
