Амінокислоти — це похідні карбонових кислот, у яких один або декілька атомів водню у вуглеводневому радикалі заміщені на аміногрупу. Залежно від розташування NH2-групи розрізняють α-, β-, γ- та інші амінокислоти. У живих організмах вони перебувають у вільному стані або входять до складу білків, пептидів, а також деяких інших біологічно активних сполук. Існує понад 300 амінокислот, наявних у різних тварин, рослин і мікробіальних системах, але лише 20 основних кодуються в ДНК і потім включаються до складу білків. Багато білків також містять модифіковані залишки цих 20 амінокислот.
Амінокислоти, що формують первинну структуру білків, є майже виключно α-А., у яких карбоксильна група і аміногрупа зв’язані з тим самим атомом вуглецю (α-вуглецевий атом). До нього також приєднаний атом водню і бічний ланцюг певної будови. Хімічна природа останнього різноманітна: від атома водню до складних циклічних сполук. Саме радикали визначають структурну і функціональну особливості амінокислот, а α-атом вуглецю в більшості з основних 20 амінокислот (крім гліцину) є хіральним, або центром асиметрії молекули. Відповідно 2 конфігурації амінокислот у просторі називаються D (dextro, або права) та L (laevо, або ліва).
Усі амінокислоти в білках є L-конфігурації:
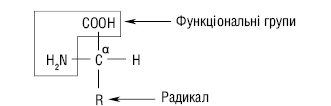
D-амінокислоти зазвичай не виявлять у складі білків, але вони наявні у деяких антибіотиках і бактеріальних клітинних стінках. Амінокислоти, що входять до складу білків, одержали назву протеїногенних. Серед них виділяють головні (це найважливіші 20) і рідкісні, які переважно є похідними тих самих амінокислот.
Напр., 4-гідроксипролін і 5-гідроксилізин, що містяться у колагені; ε-триметиллізин, який виявлено у Са2+-зв’язувальних білках та ін. Вони утворюються шляхом модифікації головних А. після їх включення до складу відповідного білка. Деякі природні амінокислоти, які не виявлені в білках, є проміжними метаболітами обміну речовин, напр. L-орнітин та L-цитрулін — учасники циклу сечовини в печінці. Назви амінокислоти будуються за замінною номенклатурою карбонових кислот (напр. α-амінопропіонова кислота), але частіше використовуються їх тривіальні назви, напр. гліцин, аланін, серин тощо. Існують також трилітерні й однолітерні позначення амінокислот, напр. гліцин — глі, G; аланін — ала, А; лейцин — лей, L. Їх використовують для позначення чергування амінокислоти у пептидах або білках. Тривіальні назви досить часто пов’язані з джерелом виділення амінокислот, або іншими ознаками. Напр. гліцин має солодкий смак (грець. glycos — солодкий); серин входить до складу білка шовку — фіброїну (лат. serius — шовковистий); тирозин був виділений із сиру (грець. tyros — сир); аспарагінова кислота — із паростків спаржі (лат. asparagus) та ін.
Амінокислоти класифікуються кількома способами залежно від ознаки, за якою відбувається їх розподіл на групи.
Прийнято три класифікації амінокислот:
- структурна — за хімічною будовою радикалу;
- електрохімічна — за кислотно-основними властивостями;
- біологічна (фізіологічна) — за ступенем незамінності амінокислоти для організму людини.
Амінокислоти аліфатичні (ациклічні) залежно від кількості аміно- і карбоксильних груп поділяються на моноаміномонокарбонові, діаміномонокарбонові, моноамінодикарбонові, діамінодикарбонові. Залежно від наявності тієї чи іншої групи в радикалі аліфатичні амінокислоти підрозділяють на гідрокси-, сірко-, амідовмісні та ін. Циклічні амінокислоти поділяють на ароматичні (карбоциклічні) та гетероциклічні, до яких належать також імінокислоти.
За електрохімічними (кислотно-основними) властивостями амінокислоти поділяють на три групи:
- кислотного характеру — з додатковими карбоксильними групами в боковому радикалі (моноамінодикарбонові кислоти: аспарагінова і глютамінова);
- основного характеру — діаміномонокарбонові: лізин і аргінін, а також гістидин;
- нейтральні — решта амінокислот.
Сучасна раціональна класифікація амінокислот ґрунтується на полярності радикалів, їх здатності до взаємодії з водою за фізіологічних значень рН (≈7,0). Вона містить 4 групи амінокислоти: неполярні (гідрофобні), бокові радикали яких не мають спорідненості з водою. До них належать аланін, валін, лейцин, ізолейцин, метіонін, пролін, фенілаланін, триптофан; полярні (гідрофільні) незаряджені — гліцин, серин, треонін, цистеїн, тирозин, аспарагін, глютамін; полярні негативно заряджені — аспарагінова і глютамінова кислоти; полярні позитивно заряджені — лізин, аргінін, гістидин.
За біологічним (фізіологічним) значенням амінокислоти поділяють на три групи:
- незамінні, які не можуть синтезуватися в організмі з інших сполук, тому мають обов’язково надходити з харчовими продуктами (їх для людини вісім: треонін, метіонін, валін, лейцин, ізолейцин, лізин, фенілаланін, триптофан);
- напівзамінні амінокислоти можуть утворюватися в організмі, але в недостатній кількості, тому частково необхідна їх наявність у білках їжі (для людини таких три: аргінін, тирозин, гістидин);
- замінні амінокислоти синтезуються в організмі в достатній кількості з незамінних амінокислот та інших сполук.
До них належить решта з 20 протеїногенних амінокислот. Вільні амінокислоти — амфотерні сполуки, що містять як мінімум дві протилежні за властивостями функціональні групи (карбоксильну й амінну) та існують у декількох іонізованих станах із дисоційованою карбоксильною групою і протонізованою аміногрупою:
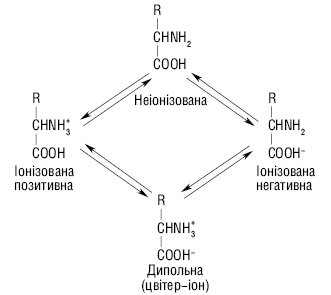
У нейтральному розчині та в кристалах домінуючою формою амінокислот є цвітер-іон. Залежно від рН середовища вони можуть мати кислі чи основні властивості. У кислому середовищі амінокислоти несуть позитивний заряд, оскільки надлишок протонів у середовищі пригнічує дисоціацію карбоксильних груп. У лужному середовищі амінокислоти перебувають у вигляді негативно заряджених іонів внаслідок дисоціації -СООН-групи. Стан, у якому заряд амінокислот дорівнює нулю, має назву ізоелектричний стан. Значення рН середовища, при якому амінокислоти досягають цього стану і не рухаються в електричному полі, називається ізоелектричною точкою (ІЕТ) і позначається рІ.
Відповідно до своєї амфотерної природи амінокислоти можуть утворювати різні солі, реагуючи як з основами, так і з кислотами. Напр.
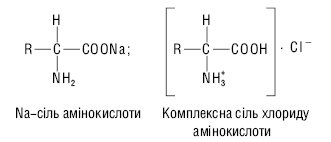
Кислотно-основні властивості амінокислот використовуються при їх розподілі та ідентифікації за методами іонообмінної хроматографії та електрофорезу. Протеїногенні амінокислоти — це переважно безбарвні кристалічні речовини, багато з яких добре розчиняються у воді й погано — в органічних розчинниках. Здатність α-амінокислот розчинятися у воді є важливим фактором, який забезпечує їх біологічні властивості. Розчинністю у воді зумовлене всмоктування амінокислот, їх транспорт в організмі, виділення з сечею тощо. Вміст амінокислот у крові людини становить близько 0,5 г/л (від 10 до 100 мкмоль/л), враховуючи і ті, що не виявлені в білках. Усього в різних органах і тканинах людини в метаболізмі беруть участь понад 80 амінокислот. Концентрацію амінокислот в сечі зазвичай визначають у мкмоль/г креатиніну, який екскретується у відносно постійній кількості, у розрахунку на одиницю маси тіла за добу. У найбільшій кількості з амінокислот в сечі наявний гліцин (400–2000 мкг/г креатиніну). Дуже важливою властивістю α-амінокислот є їхня здатність вступати в реакцію поліконденсації з виділенням молекули води за рахунок α-карбоксилу однієї А. й α-NH2-групи іншої з утворенням ковалентного амідного зв’язку (-СО-NH-) між ними, який одержав назву пептидного. Утворені при цьому поліаміди називають пептидами. Поліпептиди, які характеризуються як білки, відрізняються від власне пептидів не лише кількістю амінокислот, але й складністю просторової організації молекули.
У практичній медицині широко використовують амінокислоти (гліцин, цистеїн, метіонін, глютамінову кислоту, гістидин та ін.); похідні амінокислоти, напр. ацетил цистеїн; продукти обміну амінокислот — гамма-аміномасляну кислоту (аміналон, пантогам, гамалон), адреналін, норадреналін, дофамін та ін.; гідролізати тканинних і плазмових білків, а також суміші індивідуальних амінокислот для парентерального живлення та як плазмозамінюючі засоби (церебролізин, аміновен інфант, аміноплазмаль, аміносол, аміностерил N-гепа; желатиноль, альбумін, протамін сульфат та ін.), а також препарати калієвої та магнієвої солі аспарагінової кислоти. Широко застосовують препарати, до складу яких входять амінокислоти цистеїн і тирозин: вітайодурол, ангіотензинамід, тиреоїдин та ін.
Біологічна хімія / Л.М. Вороніна, В.Ф. Десенко, Н.М. Мадієвська та ін. — Х., 2000; Nelson D.L., Cox M.M. Lehninger Principles of Biochemistry. — N.Y., 2013.
