СПИРТИ (алкоголі) — гідроксилвмісні похідні вуглеводнів, у молекулах яких гідроксильна група (–ОН) зв’язана з атомом Карбону в стані sp3-гібридизації. Залежно від кількості –ОН-груп у молекулі розрізняють одно-, дво-, три- та багатоатомні С.; залежно від положення –ОН груп у молекулі С. можуть бути первинними (R–CH2OH), вторинними (RR’CHOH) і третинними (RR’R»COH); залежно від природи вуглеводневого радикалу, з яким зв’язана –ОН-група, С. бувають насичені (СН3ОН), ненасичені (СН2=СН–СН2ОН), ароматичні (С6Н5СН2ОН) та ін.
Таблиця. Фізичні властивості деяких спиртів
| Назва | Формула | Тпл, °С | Ткип, °С |
| Метанол (метиловий) | СН3ОН | –93,9 | 64,5 |
| Етанол (етиловий) | СН3СН2ОН | –114,15 | 78,32 |
| Пропанол-1 (н-пропіловий) | СН3СН2СН2ОН | –127 | 97,17 |
| Пропанол-2 (ізопропіловий) | СН3СН(ОН)СН3 | –85,8 | 82,86 |
| Метилпропа-нол-2 (трет-бутиловий) | (СН3)3СОН | 25,5 | 82,5 |
| Пентанол-1 (н-аміловий) | СН3(СН2)2СН2ОН | –78,5 | 138,0 |
| Гексанол-1 (н-гексиловий) | СН3(СН2)4СН2ОН | –36 | 157,47 |
| Гептанол-1 (н-гептиловий) | СН3(СН2)5СН2ОН | –34,1 | 176,3 |
| Октанол-1 (н-октиловий) | СН3(СН2)6СН2ОН | –16,3 | 195,2 |
| Нонанол-1 (н-ноніловий) | СН3(СН2)7СН2ОН | –50 | 212 |
| Додеканол-1 (лауриновий) | СН3(СН2)9СН2ОН | 26 | 255-259 |
| Гексадеканол-1 (цетиловий) | СН3(СН2)14СН2ОН | 49,27 | 344 |
| 2-Пропен-1-ол (аліловий) | СН2=СНСН2ОН | –129 | 96,9 |
| 2,6-Диметил-2,7-октадієн-6-ол (ліналоол) | (СН3)2С=СН(СН2)2 С(ОН)(СН3)–СН=СН2 |
— | — |
| Бензиловий | С6Н5СН2ОН | –15,7 | 205,8 |
| п-Метоксибен-зиловий (анісовий) | пСН3О–С6Н4–СН2ОН | 24,5–25 | 258,8 |
| 2-Фенілетанол (β-фенілетиловий) | С6Н5СН2СН2ОН | –27 | 220-222 |
| 2-Фенілпропанол-1 (β-фенілпропіловий) | С6Н5(СН2)2СН2ОН | — | — |
| Коричний | С6Н5СН=СНСН2ОН | 33 | 256-257 |
| 1,2-Пропандіол (1,2-пропіленгліколь) | СН2(ОН)СН(ОН)СН3 | –50,0 | 187,4 |
| Цис-9-октаде-ценол-1 (олеїловий) | СН3(СН2)7 –СН=СН–(СН2)7СН2ОН | 2 | 158 |
Згідно із замісниковою номенклатурою IUPAC назву С. утворюють додаванням суфіксів -ол, -діол, -тріол до назв відповідних вуглеводнів, вказуючи положення гідроксильних груп; за радикало-функціональною номенклатурою до назви відповідного радикалу додають суфікс -овий до слова «спирт»: С2Н5ОН — етанол, етиловий спирт, СН3СН(ОН)СН3 — пропанол-2, ізопропіловий спирт, СН2=СН–СН2–ОН — пропен-2-ол, аліловий спирт. Для деяких С. збереглися тривіальні назви: карбінол (СН3ОН), винний спирт (С2Н5ОН), гліцерин (СН2(ОН)СН(ОН)СН2ОН). За раціональною номенклатурою С. розглядають як похідні метанолу (карбінолу), у молекулі якого атоми водню в –СН3-групі заміщені на вуглеводневі радикали СН3СН2ОН — метилкарбінол. C. — рідини або тверді речовини, добре розчинні в органічних розчинниках; легші за воду, аліфатичні С. (С1–С3) змішуються з водою в усіх співвідношеннях, С. з С4–С5 — розчинні частково (С5 ~ 10%), вищі — практично не розчиняються; С. з С1–С3 мають характерний спиртовий запах; С4–С6 — солодкувато-задушливий (сивушний); вищі — не мають запаху. Циклоалканоли, ненасичені та ароматичні С. мають приємний аромат: пропаргіловий — НС≡С–СН2–ОН — запах герані; 2-фенілетанол — С6Н5–СН2–СН2–ОН — запах троянди. С. — асоційовані рідини (міжмолекулярний водневий зв’язок), чим пояснюються їх аномально високі Ткип (етан — 89 °С, етанол — 78,5 °С).
В ІЧ-спектрах С. існує характерна широка смуга в ділянках 3200–3240 см–1 (міжмолекулярні асоціати), 3580–3670 см–1 (вільна група ОН), 1000–1200 см–1 (валентні коливання зв’язку С=О). У ПМР-спектрах С. сигнал протона –ОН групи виявляється в ділянці 0,5–5,5 мільйонної частки; за мультиплетністю сигналу встановлюють належність до первинних (триплет), вторинних (дуплет) або третинних (синглет) С. Кислотні та основні властивості С. виражені дуже слабко рH (вода; 25 °С) СН3ОН 15,1; С2Н5ОН 15,9; (СН3)3СОН 19. Із збільшенням кількості –ОН-груп кислотні властивості С. посилюються. Як кислоти С. реагують з лужними, лужно-земельними та іншими металами, утворюючи алкоголяти, які легко розкладаються водою. У спиртовому середовищі алкоголяти піддаються іонізації з утворенням алкоксид-аніонів. Одноатомні С. майже не вступають у реакцію з лугами; дво- та багатоатомні С. утворюють алкоголяти з лугами та гідроксидами. Як основи С. здатні приєднувати протон за рахунок неподіленої пари електронів атома оксигену –ОН-групи. При взаємодії С. з сильними мінеральними кислотами утворюються естери цих кислот (надлишок кислоти). При нагріванні С. за наявності мінеральних кислот (надлишку спирту) або при пропусканні парів С. над Al2O3 відбувається реакція внутрішньомолекулярної дегідратації з утворенням етерів (R–O–R’). Вторинні спирти за цих умов дають суміш етерів та алкенів, третинні та вищі С. — переважно алкени. З органічними кислотами (реакція естерифікації) С. дають естери, реакція оборотна, відбувається за наявності каталізаторів (H2SO4, HCl, BF3) з надлишком С. та витісненням води. Естери утворюються також при взаємодії С. з ангідридами, галогенангідридами, нітрилами карбонових кислот, кетенами:
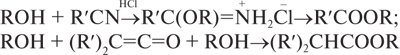
Взаємодія С. з ізоціанатами призводить до утворення естерів карбамінової кислоти (уретанів):
![]()
С. реагують з альдегідами за наявності мінеральних кислот, п-толуолсульфокислоти та ін. з утворенням напівацеталей. Дією на С. концентрованої HCl, галогенідів фосфору, тіонілхлориду (за наявності піридину) та ін. відбувається заміщення групи –ОН на галоген (легкість реакції зростає при переході від первинних С. до третинних). С. легко окиснюються; окиснення проводять K2Cr2O7 за наявності H2SO4 (хромової кислоти); KMnO4, H2SO4 (манганової кислоти) тощо; первинні С. утворюють альдегіди, вторинні — кетони, третинні — стійкі до окиснення, проте за жорстких умов здатні окиснюватися із розщепленням молекули та утворенням суміші кетонів і карбонових кислот.
У промисловості для одержання альдегідів і кетонів часто використовують метод каталітичного окиснення С. киснем повітря та каталітичного дегідрування (пропускання парів спирту над подрібненою міддю при температурі 250–400 °С): СН3СН2ОН >СН3СНО. С. отримують при бродінні цукру або крохмалю під дією ферментів дріжджів; продуктом бродіння є рідина, яка містить 12–18% етилового спирту, суміш спиртів (С3–С9), так зване сивушне масло, невелику кількість гліцеролу та ін. Сухою перегонкою деревини добувають метиловий спирт. Ресурси природних джерел для добування вищих жирних С. обмежені; більшість вищих насичених С. з парною кількістю атомів карбону в молекулі в промисловості головним чином добувають із кислот такого ж складу (С6, С8, С10, С12, С14, С16, С18) або їх естерів, які містяться у тваринних та рослинних жирах, восках; вищі С. з непарною кількістю атомів карбону в молекулі в природі не зустрічаються і їх добувають синтетичним шляхом. Синтетичними методами добування С. є гідратація олефінів за наявності H2SO4 або H3PO4 (С. з С2–С4); гідроліз: алкілсульфатів (C2H5OH, ізо-C3H7OH, трет-C4H9OH); галогенопохідних вуглеводнів (аміловий, бензиловий спирт); оксосинтезом (поряд з CH3OH утворюються C3H7OH, ізо-C4H9OH, н-C4H9OH, вищі жирні спирти); окисненням нормальних парафінів (Ткип 270–320 °C) азоткисневою сумішшю (4–5% О2) (вищі жирні спирти). Первинні С. (у т.ч. й ароматичні) — за реакцією Канніццаро або взаємодією бензену з алкенооксидами за наявності AlCl3; ацетиленові — за реакцією Реппе. Використовують також і інші методи синтезу.
У вільному стані С. зустрічаються рідко в незначній кількості, але у вигляді етерів та естерів вони широко розповсюджені в природі; естери олеїлового С. та вищих карбонових кислот входять до складу спермацетового та інших природних масел та олій; естери мірицилового С. пальмітинової та церотинової кислот містяться у бджолиному і карнаубському восках; коричний С. — у гіацинтовій олії, перуанському бальзамі, смолі амбрового дерева; фенілетиловий С. — у трояндовій, гвоздичній, геранієвій олії.
У фармації численна кількість С. та їх похідних мають широкий спектр застосування як ЛП: снодійної дії: хлорбутанолгідрат; проти хвороби Паркінсона: тригексифенідил; адреноміметики: фенілефрин, фетанол, ізадрин, фенотерол, сальбутамол; антиадренергічної дії: бензозиксин, піндолол, тіолол; антибіотик: хлорамфенікол; для лікування променевої хвороби: батилол; препарати, які впливають на тканинний обмін: трисамін, заліза (феруму) гліцерофосфат; 3% розчин полівінілових спиртів з малою мол. м. (10 000 ± 2000) — медичний препарат гемодез, а 10% розчин використовується як пролонгуючий розчинник та для виготовлення мазевих основ, очних плівок та ін. С. використовують як антимікробні консерванти (бензиловий, β-фенілетиловий спирт тощо), антиоксиданти, емульгатори або солюбілізувальні речовини (С. шерстяного воску, олеїновий, пропіленгліколь), пластифікатори, зволожуючі та ущільнюючі речовини (поліетиленгліколь, гліцерол, цетиловий спирт), розчинники, основи для супозиторіїв (зокрема поліетиленгліколь), речовини для суспендування (напр. пропіленгліколь). У парфумерно-косметичній промисловості широко використовуються для створення композиції ароматів та віддушок С., які мають приємні запахи: пентанол-1 — фруктовий; гідрокоричний та коричний — запах гіацинту та троянди, нанол-1 — цитрусових та троянд. Для створення запаху геліотропу, жимолості або бузку використовують анісовий С. β-Фенілетиловий С. має запах троянди, його використовують як основу композицій із запахом жасмину, нарцису, конвалії. Естер β-фенілетилового спирту і капронової кислоти має запах меду і використовується в харчовій промисловості.
Неницеску К.Д. Органическая химия. — М., 1963. — Т. 2; Общая органическая химия: В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 8. Азотсодержащие гетероциклы / Под ред. П.Г. Сэммса. — М., 1985; Черних В.П. Зіменковський Б.С., Гриценко І.С. Органічна хімія / За заг. ред. В.П. Черних. — Х., 2008.
