ОКСИДАЦІЯ (англ. oxidation, рос. окисление, син. окиснення, оксигенація) — хімічний процес повної або часткової втрати одного чи декількох електронів субстратом (молекулою, атомом, іоном) з утворенням іонів або молекул із полярним чи напівполярним зв’язком або втрата атомів Гідрогену чи приєднання атомів Оксигену або інших електронегативних атомів, що приводить до підвищення його ступеня О. Зменшення негативного заряду на атомі під час перебігу реакцій при хлоруванні метану або N-оксидації третинного аміну пероксикарбоновою кислотою з утворенням відповідного N-оксиду вважаються процесами О. карбону метану або Нітрогену в молекулі третинного аміну відповідно; вилучення атомів Гідрогену з молекул органічних речовин зі збільшенням кратності зв’язків (напр. у реакції дегідрування вуглеводнів) або заміщення на більш електронегативні атоми, напр. на Оксиген — типові процеси О. Перетворення органічного субстрату, який починається із втрати електрона, а відтак супроводжується втратою води, Гідронію, H3O+ чи гідроксильного іона, чи спостерігається нуклеофільне заміщення молекулою води чи зворотна реакція із внутрішньомолекулярним перегрупуванням — теж належить до процесу О. субстрату.
Na — e− 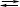 Na+ (1)
Na+ (1)
Fe2+ — e− 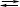 Fe3+ (2)
Fe3+ (2)
CH4 + Cl2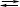 CH3Cl + HCl∙ (3)
CH3Cl + HCl∙ (3)
R3N + RCO3H 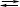 R3N→O + RCO2H (4)
R3N→O + RCO2H (4)
R1R2СН— СНR1R2 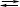 R1R2С=С R1R2 (5)
R1R2С=С R1R2 (5)
 |
(6) |
CН3СН2ОН 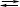 СН3СНО
СН3СНО 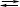 СН3СООН (7)
СН3СООН (7)
Так, утворений у мозковій речовині надниркових залоз гормон адреналін посилює фосфороліз, а відтак активує глікогеноліз та пов’язаний із ним процес аеробної О. вуглеводнів, підвищуючи тканинне дихання та газообмін, підвищує також обмін білків та ліпідів у живому організмі, піддаючись багатостадійному процесу О.: при відщепленні двох Гідрогенів від гідроксильних груп перетворюється на дегідроадреналін, який внаслідок циклізації бічного ланцюга необоротно перетворюється у гетероциклічну сполуку — адренохром, а відтак, внаслідок втрати додатково ще двох атомів Гідрогену оксидується в оксоадренохром, які здатні оборотно перетворюватися на свої лейкоформи, а саме — лейкоадренохром та лейкооксоадренохром відповідно.
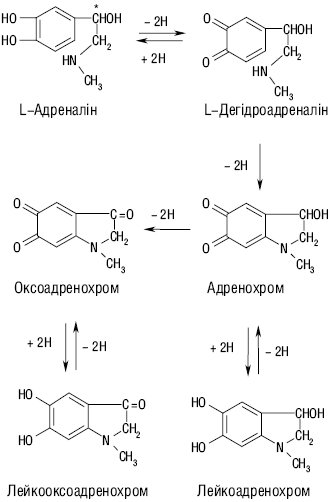
Рисунок. Схема оксидації L-адреналіну
В органічній хімії О. класифікується як перетворення однієї функціональної групи на іншу — більш вищої категорії. При розгляданні органічних сполук часто корисно оцінювати ступінь О. будь-яких молекул або групи віднесенням їх до послідовних стадій О. метану: СН4, СН3ОН, СН2О, НСООН, СО2; з цієї точки зору доцільно припустити, що гідроліз біля карбонового центра, чи приєднання, або відщеплення елементів води, не є ні О., ні відновленням. Виходячи з цього, реакція (3) є оксидаційним процесом, оскільки CH3Cl перебувають у цьому ж оксидаційному стані, що й СН3ОН. На противагу цьому, реакція (8) становить процес відновлення, а реакція (9) є ні оксидаційним процесом, ні відновленням.
CH3Cl + Mg 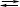 CH3MgCl (8)
CH3MgCl (8)
СН3СООН ↔ СН3СОО– + H+ (9)
Додамо до цього, що вуглевод С6Н12О6 та тріоксибензен С6Н3(ОН)3 перебувають в однакових оксидаційних станах.
Загалом сполуки, які можна добути одну з одної шляхом приєднання чи втрати молекули води або її еквівалента, розглядаються як такі, що мають однакові оксидаційні стани, хоча це не є завжди так. Напр., при видаленні елементів води з альдоксиму утворюється нітрил і відбувається зміна оксидаційного стану від альдегіду до кислоти. Водночас при дегідратації аміду в нітрил не змінюється оксидаційний стан функціональної групи: при перетворенні оксиму на нітрил кількість зв’язків електронегативного атома з атомом Карбону функціональної групи збільшується від двох до трьох, однак і в аміді, і в нітрилі існує три зв’язки атома Карбону з електронегативними атомами (з Нітрогеном і з Оксигеном та з Нітрогеном — відповідно).
Заміщення електронегативної групи біля атома Карбону на іншу електронегативну групу, напр. перетворення гемінального дихлориду RCHCl2 на гемінальне діацетоксипохідне RCH(OAc)2, не викликає змін загального оксидаційного стану атома Карбону функціональної групи. Водночас заміщення атома Гідрогену, зв’язаного з Карбоном, на замісник більш електронегативний, ніж Гідроген, приводить до О. цього атома. Так, заміщення Гідрогену в арені на галоген або приєднання галогену до арену є, без сумніву, також оксидаційним процесом.
Таблиця. Прості функціональні групи, розташовані в порядку збільшення їх оксидаційного стану. Збільшення оксидаційного стану: зліва — направо
| RH | −C=C− | −C≡C− | RCO2H | CO2 |
| ROH | RCOR | RCO2R | CCl4 | |
| RCl | RCH=NOH | RCONH2 | тощо | |
| RNH2 тощо |
R2C(OH)−CR2(OH) R2C(Cl)−CR2(Cl) тощо |
RC≡N тощо |
Для хіміка-неорганіка твердження, що О. еквівалентна втраті, а відновлення — придбанню електрона, як у реакціях (1) і (2), придатне для опису реакцій речовин, здатних іонізуватися. Розвиваючи ці погляди, фізико-хіміки порівнюють оксидаційну здатність різних іонів, вимірюючи окисно-відновні (оксидаційні) потенціали, які є мірою зміни вільної енергії у термодинамічних оборотних рівновагах, але часто невиправдано розраховуються із значень ентальпії необоротних реакцій. Однак ці погляди менш чітко застосовуються в органічній хімії, оскільки при О. карбонових сполук їх атоми дуже рідко позбавляються навколишніх заповнених електронних оболонок. До того ж лише небагато з реакцій О. органічних сполук є оборотними, а отже, формулювання схеми реакції щодо зменшення загальної вільної енергії не гарантує, що така реакція може бути здійснена. Важливо простежити переміщення валентних електронів, яке має місце у будь-якому найпростішому процесі О., напр. у реакції (3). Якщо дотримуватися точки зору, що кожна органічна сполука перебуває у певному ступені О., то можна сказати, що СН3Cl знаходиться у більш окисненому стані, ніж СН4, у той час, як розглядаючи лише ці дві молекули, було б важко стверджувати, що електрони видалені з метану при перетворенні його на СН3Cl. Однак кожну хімічну реакцію слід розглядати як ціле, і тоді при підрахунку електронів виявляється, що два атоми хлору початково зв’язані в молекулу Сl2 з 14-валентними електронами, а в результаті — у СН3Cl + НСl з 16-валентними електронами. Очевидно, що Хлор відновлюється, а отже, метан оксидується; два електрони насправді набуті разом з ядром Гідрогену, який заміщений Хлором.
При гідролізі
CН3– Cl + OH — 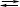 CН3OH + Cl– (10)
CН3OH + Cl– (10)
має місце перенесення електронів, але загалом у цьому разі не відбувається ні втрата, ні придбання електронів ніяким продуктом реакції, оскільки Cl– володіє такою ж кількістю валентних електронів, що й OH–.
Розривання ковалентного зв’язку є основною особливістю органічних реакцій і може здійснюватися двома шляхами: шляхом гомолітичних (радикальних) реакцій, коли електронні пари розриваються симетрично, та шляхом гетеролітичних (іонних чи іон-молекулярних) реакцій, коли електронні пари переходять від однієї частинки до іншої як єдине ціле.
При гомолітичній О. електрони втрачаються по одному із органічних молекул активними атомами, напр. Хлором, або активними вільними радикалами. Хоча цим шляхом можуть оксидуватися і молекули, які містять неподілені електрони, зазвичай гемолітична О. полягає у втраті органічною молекулою одного електрона разом з ядром Гідрогену, напр.:
R3C — H + ∙Cl 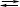 R3C∙ + H–Cl (11)
R3C∙ + H–Cl (11)
Вихідна органічна речовина обов’язково має неспарений електрон, і тому він має за сприятливих умов піддатися реакції подібного типу, напр.:
R3C∙ + Сl–Cl 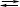 R3C — Cl + ∙Cl (12)
R3C — Cl + ∙Cl (12)
або сполучитися з іншим вільним радикалом з утворенням однієї стійкої частинки. Таким чином, ланцюгові реакції, димеризація або диспропорціювання, напр.:
2 R3C∙ 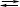 R3C–СR3 (13)
R3C–СR3 (13)
є типовими реакціями гемолітичної О.
Усі гомолітичні процеси перенесення електрона, такі, як реакції (10–13), вимагають значно меншої енергії активації, ніж необхідно для безпосереднього розривання ковалентного зв’язку. Тому почавшись, гомолітична О. відбувається дуже швидко. Невелика кількість вільних радикалів, необхідних для ініціювання гомолітичної О., може утворюватися під час термічної дисоціації молекул під впливом α-променів або електронів (β-променів) або просто внаслідок перенесення електронів від іонів перехідних елементів із незаповненими внутрішніми (d) електронними рівнями. Напр. пероксид бензоїлу під дією УФ-променів піддається гомолітичному розкладенню з утворенням радикалів С6Н5С(О)О∙ (14), які ініціюють полімеризацію метилметакрилату — діючої речовини пломбувального матеріалу відомих стоматологічних препаратів.
С6Н5С(О)О-o(o)c С6Н5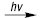 2 С6Н5С(О)О∙ (14)
2 С6Н5С(О)О∙ (14)
Гетеролітична О. полягає в атаці органічних сполук електрофільними агентами, які можуть простим способом набувати контролю над ще однією електронною парою. Гетеролітичні окисники тому атакують легкодоступні електронні пари таких атомів, як Оксиген, Нітроген або Сульфур, або вільно розташовані π-електрони олефінів, а не важкодоступні електронні пари зв’язків ≡С–H, –O–H або =N–H. До того ж гетеролітичні реакції призводять до утворення стійких молекулярних або іонних сполук в одну або переважно у дві стадії та дуже рідко відбуваються як ланцюгові реакції. З іншого боку, вони потребують порівняно більшої енергії активації, ніж гомолітичні реакції, і тому є більш повільними процесами. Для перебігу таких реакцій не завжди обов’язкова наявність каталізаторів, проте, якщо навіть це необхідне, то каталізатори — основи або кислоти Льюїса — повністю відрізняються від таких, які використовуються для промотування гомолітичних реакцій.
Розглядання стереохімії значно важливіше при гетеролітичних, ніж при гомолітичних реакціях, оскільки при будь-якій гетеролітичній реакції, напр. реакції (10), продукт реакції та вихідна речовина мають завжди подібні тетраедричні конфігурації, у той час як при гомолітичній реакції, напр. (11), три залишених ковалентних зв’язки в утвореному вільному радикалі розташовані в одній площині біля карбонового центра, і тому наступна реакція (12) приводить до суміші стереоізомерів.
Гетеролітичний окисник підходить до тієї частини органічної молекули, де до валентних електронів найбільший доступ: у крайньому разі продукти електрофільного приєднання до зв’язків, подібних до =С=С= або =С=О, є стереоспецифічними, а не сумішшю ізомерів. Крім того, гетеролітична О. часто проходить багатостадійно з кінцевою стадією відщеплення від органічного комплексу окисника разом із додатковим протоном. Простим прикладом є реакція:
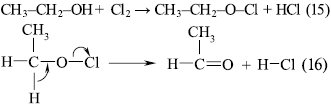
У процесі елюмінації за рівнянням (16) відбувається переміщення електрона одночасно за зв’язками ≡С–Н, ≡С–О– та –О–Сl, тому що в протилежному випадку мають утворюватися проміжні іони з великим вмістом енергії, напр. СН3–СН2–О+. Упродовж такого узгодженого процесу валентні електрони всіх зв’язків гібридизуються з утворенням активованого стану, який володіє мінімальною енергією, а оскільки всі зв’язки, які об’єднують атоми Карбону, певною мірою мають просторовий р-характер, то оптимальним є такий активований стан, в якому всі новоутворені зв’язки копланарні. У багатьох випадках елімінування лінійний перехід електронів промотується наявністю кислотних або основних каталізаторів, у деяких випадках під час О. має місце циклічний перехід електронів без проміжного утворення перехідного комплексу.
О. поряд із гідролізом є одним із основних негативних процесів, що призводять до руйнування ліків та харчових продуктів (див. Автоокиснення).
З іншого боку, це процеси перетворення біологічних субстратів у живих організмах, які відповідальні за вивільнення енергії (див. Окиснення біологічне, Жирні кислоти), а також становлять один із шляхів метаболізму (процеси β-окиснення та гідроксилювання в мітохондріях клітин).
Глосарій термінів з хімії / Уклад. Й. Опейда, О. Швайка. — Донецьк, 2008; Марч Дж. Органическая химия. Реакции, механизмы и структура: пер. с англ. В 4 т. — Т. 4. — М., 1988; Уотерс У. Механизм окисления органических соединений: Пер. с англ. — М., 1966; Хейнс А. Методы окисления органических соединений: Алканы, алкены, алкины и арены: Пер. с англ. — М., 1988.
