КРИВІ ТИТРУВАННЯ — графічна залежність параметра системи, пов’язаного з концентрацією визначуваної речовини, титранту чи продукту реакції від складу розчину в процесі титрування. К.т. наочно представляють хід реакції, покладеної в основу титриметричного аналізу. У процесі титрування змінюються рівноважні концентрації речовин (визначуваної речовина, титранту та продуктів реакції). Пропорційно концентраціям компонентів змінюються властивості розчинів, напр. рН, значення потенціалу Е та ін. Якщо на осі ординат відкладають логарифм концентрації чи величину, пропорційну цьому логарифму, одержують логарифмічні К.т. (рис. 1). Якщо на осі ординат відкладають відношення зміни параметра, пов’язаного з концентрацією, до зміни об’єму доданого титранту, напр. ΔE/ΔV, одержують диференційні К.т. (рис. 2); якщо на осі ординат відкладають концентрацію або фізико-хімічний параметр, пропорційний концентрації, одержують лінійні К.т. (рис. 3).
По осі абсцис (найчастіше) відкладають об’єм доданого титранту чи ступінь відтитрованості ƒ (відношення кількості відтитрованої речовини до вихідної кількості речовини).
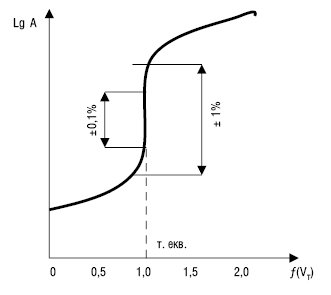
Рис. 1. Логарифмічна К.т.
На рис. 1–3: т. екв. — точка еквівалентності
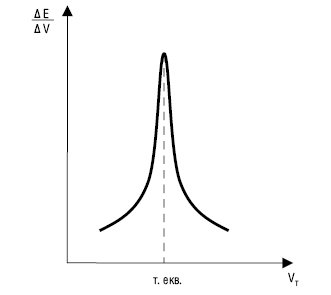
Рис. 2. Диференційна К.т.
Логарифмічні К.т. мають s-подібну форму. До точки еквівалентності спостерігається повільна, а поблизу точки еквівалентності — різка зміна параметра, пов’язаного з концентрацією. При цьому до точки еквівалентності за ходом титрування стежать за зміною параметра, пов’язаного з концентрацією визначуваної речовини, зокрема зміною: рН (кислотно-основне титрування), pHal (титрування за методом осадження — аргентометрія), рМе (хелатометричне титрування), Е (окисно-відновне титрування).
Після точки еквівалентності за ходом титрування стежать за зміною параметра, пов’язаного з рівноважною концентрацією титранту. На ділянку різкої зміни параметра (стрибок титрування) впливають ряд факторів: константа рівноваги реакції, концентрація речовин, температура, іонна сила. Точку еквівалентності знаходять прямолінійною екстраполяцією гілок К.т. до їх перетину. Для більш точного визначення точки еквівалентності використовують не інтегральні, а диференційні К.т., напр. в окисно-відновному титруванні (рис. 2).
Якщо на осі ординат відкладають властивість системи, прямо пропорційну концентрації визначуваної речовини, титранту або продукту реакції, одержують лінійні К.т. Такою властивістю може бути електродний потенціал, оптична густина, електрична провідність та ін. На рис. 3 наведені лінійні К.т. різних типів:
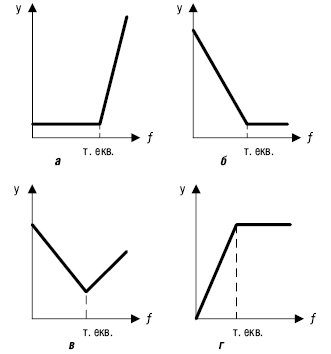
Рис. 3. Лінійні К.т.: а — сигнал, зумовлений титрантом; б — сигнал, зумовлений визначуваною речовиною; в — сигнал, зумовлений визначуваною речовиною і титрантом; г — сигнал, зумовлений продуктом взаємодії титранту та визначуваною речовиною
Різкий перетин у точці еквівалентності спостерігають, якщо константа рівноваги К≥103. Лінійні К.т. одержують експериментально при фотометричному, амперо- та кондуктометричному, термометричному або радіометричному титруванні.
Кристиан Г. Аналитическая химия: В 2 т. / Пер. с англ. — М., 2009; Основы аналитической химии: В 2 т. / Т.А. Большова, Г.Д. Брыкина, А.В. Гармаш и др.; под ред. Ю.А. Золотова. — 4-е изд. — М., 2010; Руководство по аналитической химии / Пер. с нем. под ред. проф. Ю.А. Клячко. — М., 1975.
