КИСЛОТА КАРО. Пероксомоносульфатна кислота, Н2SO5, відома у англомовній літературі як Peroxymonosulfuric acid, або кислота Каро (Caro’s асіd), названа на честь свого першовідкривача Генріха Каро (1898), — безколірна надзвичайно гігроскопічна тверда кристалічна сполука з Тпл 45 ˚С (розкл.), яка потребує обережного поводження через небезпеку вибуху. Мол. м. 114,08 г/моль. Її можна розглядати як похідне сульфатної кислоти, у якій одна ОН-група заміщена на ООН-групу. Шестивалентний сульфур знаходиться у центрі тетраедра структури: HO-O-S(O)2-OH.
Лабораторний метод добування хімічно чистої К.К. полягає у взаємодії хлорсульфонової кислоти з гідрогенпероксидом:
Н2О2 + СlSO2OH Н2SO5 + HCl.
Н2SO5 + HCl.
Її можна також добути дією концентрованої сульфатної кислоти на пероксодисульфати, і вона утворюється як побічний продукт при добуванні Н2S2O8 електролізом водної сульфатної кислоти.
K2S2O8 + Н2SO4 + H2O = Н2SO5 + 2KHSO4.
Розчини у сульфатній кислоті більш стійкі. Водні розчини повільно гідролізуються:
Н2SO5 + H2O = Н2SO4 + H2O2.
Вона є двоосновною кислотою, у водних розчинах дисоціює за рівняннями:
H2SO5 + Н2О = Н3О+ + HSO5– рКа1 ≈0,4,
HSO5– + Н2О = Н3О+ + SO52– рКа2 =9,3.
При рН 9,3 концентрація гідрогенпероксомоносульфат-іонів HSO5– та SO52– іонів приблизно однакова. Наявністю цих іонів і визначається поведінка К.К. у лужних розчинах. Діаніон SO52– внаслідок того, що він легко втрачає атом Оксигену, є енергійним окисником. Тому оксидаційні властивості К.К. в лужному середовищі виражені сильніше, ніж редукційні. Діаніон SO52– легко взаємодіє з гідрогенпероксомоносульфат-аніоном, який є донором Гідрогену:
SO52– + HSO5– + OH– = О2↑ + Н2О + 2 SO42–.
Внаслідок перебігу цієї реакції лужні розчини К.К. нестійкі.
Розрахований стандартний електродний потенціал для системи
HSO5– + 2 H+ + 2 e– = HSO4– + H2O
становить +1,84 В, а для системи
SO52– + Н2О + 2 ē = SO42– + 2ОН–
+1,22 В стосовно НВЕ.
Залежність окисно-відновного потенціалу системи пероксомоносульфат/сульфат від рН виражається рівняннями
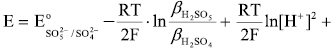
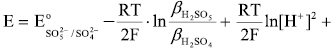
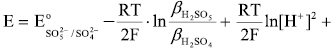
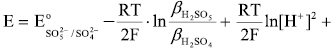
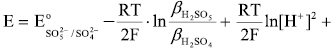
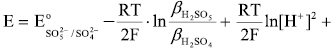
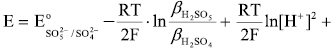
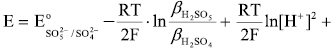
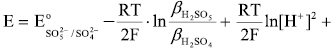
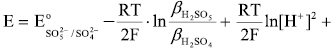
та визначається рівновагами:
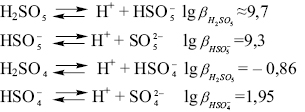
де 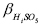 та
та 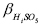 — загальні константи утворення (стійкості) протонованих частинок окисненої НіSO5 та відновленої НіSO4 форм системи;
— загальні константи утворення (стійкості) протонованих частинок окисненої НіSO5 та відновленої НіSO4 форм системи;
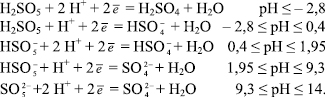
Розрахована за рівняннями залежність окисно-відновного потенціалу від рН середовища системи пероксомоносульфат/сульфат 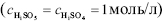 наведена на рисунку.
наведена на рисунку.
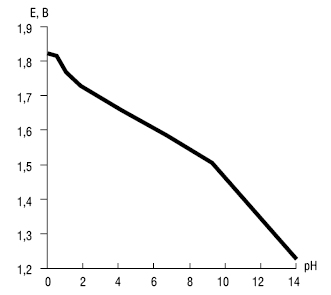
Рисунок. Залежність окисно-відновного потенціалу системи пероксомоносульфат/сульфат від рН середовища
Концентрацію розчину К.К. встановлюють йодометричним титруванням, а в деяких випадках — титруванням стандартним розчином арсеніту. Її солі, які краще називати тріоксопероксосульфатами(2–), ніж пероксомоносульфатами, нестійкі. Будова аніона [HOOSO3]–, який є активною частиною К.К., була встановлена рентгеноструктурним аналізом гідратованої солі складу КHSO5·H2O; деякі параметри такі: О–О 0,1400 нм; S–O2 0,1632 нм; S–O1 0,1435–0,1444 нм; кут О–О–S 109,4˚.
Практичне значення має її достатньо стійка калійна потрійна сіль — 2КНSO5∙КНSO4∙К2SO4, яка випускається хімічною промисловістю і знаходить широке застосування як засіб хімічної дезінфекції та стерилізації класу окисників, у тому числі для басейнів; для делігніфікації деревини, як знешкоджувач ціанідів та бойових отруйних речовин, ініціатор радикальної полімеризації; знебарвлювач олій, як окисник в органічному синтезі та фармацевтичній промисловості, а також як реагент в аналітичній та фармацевтичній (Bh Ph, 2009) хімії. Розчини К.К. поки що порівняно мало застосовуються у практиці хімічного аналізу.
Гринвуд H.H., Ерншо А. Химия єлементов: В 2 т. Т.2. — М., 2008; Карякин Ю.В., Ангелов И.И. Чистые химические вещества. Изд. 4-е, пер. и доп. — M., 1974; Caro H. Zur Kenntniss der Oxydation aromatischer Amine // Zeitschriff für angewandste Chemie. — 1898. — № 11. — № 36; Csányi L.J. Űber das Oxydationspotential der Peroxysäuren von Schwefel // Naturwissenschaften. — 1956. — V. 43. — № 2; Jukka K. The second dissоciation constant of Caro’s acid catalyzed by ketones // J. Org. Chem. — 1981. — V. 46. — № 8; Spiro M. The standard potential of the peroxosulphate /sulphate couple // Electrochem. Acta. — 1979. — V. 24; Steele W.V., Appelman E.H. The standart enthalpy of farmation of peroxomonosulphate (HSO5–) and the standard electrode potential of the peroxomonosulphate-bisulphate couple // J. Chem. Thermodyn. — 1982. — Vol. 24. — № 4; Structure, deformation density and atomic charges in potassium hydrogenperoxomonosulfate monohydrate, KHSO5·H2O / E.O. Schlemper, R.C. Thompson, C.K. Fair et al. // Acta Cryst. — 1984. — V. 40, Part 11.
