СКЛЯНИЙ рН—ЕЛЕКТРОД — різновид іоноселективного електроду, оборотного до іонів гідрогену, з твердою скляною мембраною, яка має іонну провідність і розділяє дві однорідні фази, в одній з них активність іонів гідрогену, що визначають, постійна. Конструктивно цей електрод становить скляний циліндр, який закінчується тонкою у вигляді кулі перегородкою зі скла спеціального складу (мембрани) (рисунок).
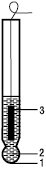
Рисунок. Скляний рН-електрод: 1 — кулька з електродного скла; 2 — 0,1 М розчин HCl; 3 — хлоридосрібний електрод
До складу мембрани входить велика кількість лужних та лужноземельних металів, тому вона має нижчий електричний опір, ніж звичайне скло. Скляну мембрану вимочують у 0,1 М розчині НСl. Іони гідрогену, здатні до обміну з іонами лужних металів, розподіляються в інертній матриці нерухомої кристалічної ґратки скляної мембрани із фіксованими іоногенними групами SiO32– (у поверхневому шарі гідратованого гелю). Потенціал С.рН-е. встановлюється швидко і не залежить від наявності в розчині сторонніх окисників чи відновників, ПАР та інших речовин, які отруюють платину, як у випадку водневого електроду. При обміні іонів утворюється мембранний потенціал, значення якого визначається співвідношенням активності іонів гідрогену в обох фазах відповідно до рівняння Петерса — Нернста. Оскільки активність іонів гідрогену внутрішнього розчину електроліту (0,1 М НСl, деколи з додаванням хлориду калію) є сталою величиною, потенціал С.рН-е. (φ) лінійно залежить від активності іонів гідрогену із зовнішнього боку скляної мембрани — величини рН випробуваного розчину: 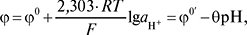
де: φ0´ — стандартний потенціал, який залежить від сорту скла мембрани та виду внутрішнього електрода;
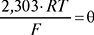
кутовий коефіцієнт електродної функції (при Т=298 К; θ=0,059).
Більшість електродів не здатна розрізняти іони Н+ від К+, Na+, Li+ при рН >12,0, але є електроди, які можуть давати правильні результати аж до рН 14 (напр. С.рН-е. типу ЕСЛ-63-07). Помилка вимірювання рН при використанні С.рН-е. в інтервалі 2–10 не перевищує ±0,05 рН. Недоліком С.рН-е. є нестабільність у часі так званого потенціалу асиметрії (входить до величини φ0´), спричиненого нерівноцінністю зовнішньої та внутрішньої поверхні скляної мембрани. Тому слід періодично градуювати електрод за еталонними буферними стандартними розчинами з точно відомим значенням рН. Причиною неправильних показань можуть бути також статичні електричні заряди, які виникають при вилученні електроду з випробуваного розчину або при його протиранні. С.рН-е. придатний для вимірювання рН не тільки істинних, але й колоїдних розчинів, напр. білків, а також емульсій, суспензій, паст. Мікро-С.рН-е. призначений для дослідження процесів у клітинах та тканинах живого організму. Однак слід пам’ятати, що вимірюванню рН можуть заважати дегідратуючі агенти. Неправильні результати одержують у розчинах із низькою буферною ємністю, напр. у воді. С.рН-е. має високий електричний опір (107–108 Ом), тому для вимірювання його потенціалів необхідний спеціальний високоомний електронний вольтметр — іономір (рН-метр) (див. Іономір (рН-метр)). Щодо практичного застосування див. Потенціометричне визначення рН.
Бейтс Р. Определение рН. Теория и практика. — Л., 1972; Никольский Б.М., Мастерова Е.А. Ионселективные электроды. — Л., 1980.
