ФЛАВОНОЇДИ — група БАР поліфенольного характеру з загальною формулою С6–С3–С6. Назва походить від лат. flavus — жовтий, оскільки перші виділені Ф. кверцитрин (з кори дуба), рутин (з рути та гречки), робінін (з акації) мали жовте забарвлення.
Молекула Ф. складається з двох фенільних залишків (кільця А і В), з’єднаних пропановою ланкою. Ці кільця можна розглядати як похідні фенілпропаноїдів.
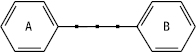
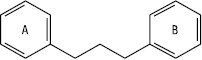
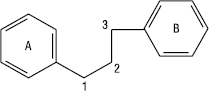
Класифікація Ф. здійснюється на основі ступеня окиснення пропанового фрагмента, місця приєднання фенільного кільця В до пропанового фрагмента і величини окисного циклу. Група Ф. містить 3 основні підгрупи, які відрізняються за місцем приєднання кільця В до пропанового фрагмента.
І підгрупа — власне флавоноїди, або справжні флавоноїди, або еуфлавоноїди — мають загальну формулу:
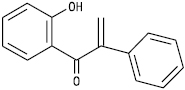
ІІ підгрупа — ізофлавоноїди
Ізохалкон
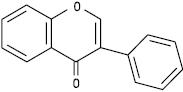
Ізофлавон
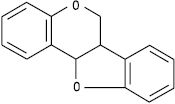
Птерокарпан
ІІІ підгрупа — неофлавоноїди
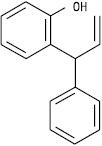
Неохалкон
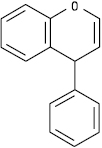
Неофлавон
Класифікація еуфлавоноїдів. За ступенем окисненості пропанового фрагмента і величиною гетероциклу еуфлавоноїди можна розділити на 10 класів, похідні 2-фенілхроману і 2-фенілхромону.
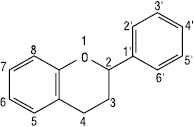
2-Фенілхроман
2-Фенілбенз-піран
Флаван
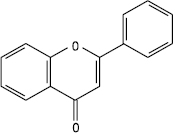
2-Фенілхромон
2-Фенілбенз-γg-пірон
Флавон
Похідні 2-фенілхроману
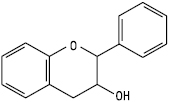
Флаван-3-ол
(катехін)
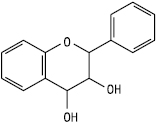
Флаван-3,4-діол
(лейкоантоціанідин)
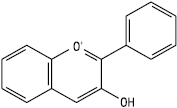
Антоціанідин
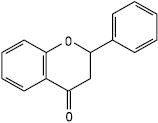
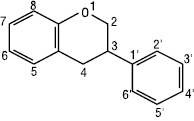
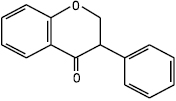
Флаванон
Похідні 2-фенілхромону
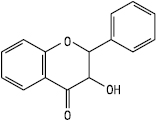
Флаванонол
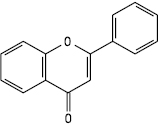
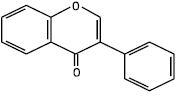
Флавон
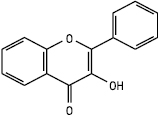
Флавонол
Гетероцикл може бути п’ятичленним, тоді утворюється клас ауронів, які можна розглядати як похідні 2-бензиліденкумарону.
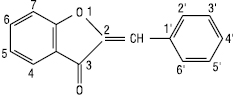
Аурон
Ф. з відкритим пропановим фрагментом називаються халконами та дигідрохалконами.
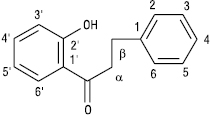
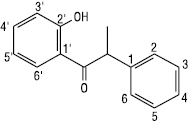
Халкон
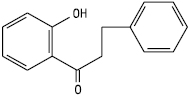
Дигідрохалкон
Ф. можуть конденсуватися з такими фенольними сполуками: фенолкарбоновими, оксикоричними кислотами, лігнанами, ізопреном, а також іншими БАР. Часто конденсуються між собою катехіни, а також катехіни з лейкоантоціанідинами, утворюючи групу поліфенолів — конденсованих дубильних речовин (танідів).
В основі класифікації ізофлавоноїдів лежить ступінь окиснення пропанового фрагмента, наявність і характер гетероциклів та конденсованих дигідрофуранових і дигідропіранових структур.
Прості ізофлавоноїди:
Ізофлаван
Ізофлаванон
Ізофлавон
Ізодигідрохалкон
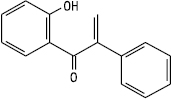
Ізохалкон
Конденсовані ізофлавоноїди
Похідні γ-пірану
Прості птерокарпани:
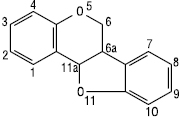
Кумаранохроман або птерокарпан
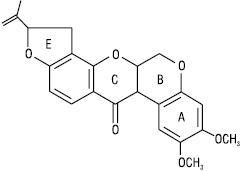
Хроманохроманон або ротенон
Похідні α-пірону
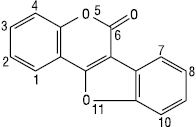
Куместан
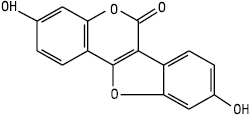
Кумаронокумарин (куместрол)
Неофлавоноїди
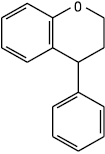
Неофлаван
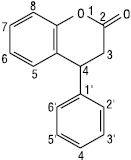
4-Фенілбензо-α-пірон (4-Фенілкумарин)
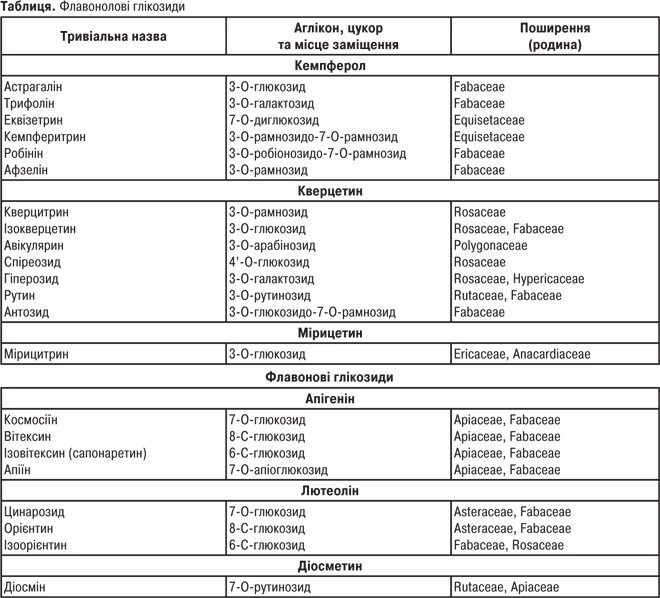
Найбільш поширені флавоноїди
Катехіни
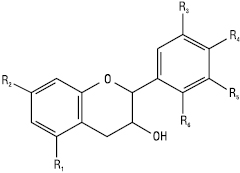
| Назви | R1 С-5 |
R2 С-7 |
R3 С-3 |
R4 С-4 |
R5 С-5 |
R6 С-4 |
| Катехін | ОН | ОН | ОН | ОН | Н | Н |
| Робінетинідол | Н | Н | ОН | ОН | ОН | Н |
| Лейкоробінетидін | Н | ОН | ОН | ОН | ОН | ОН |
| Галокатехін | ОН | ОН | ОН | ОН | ОН | Н |
Антоціанідини
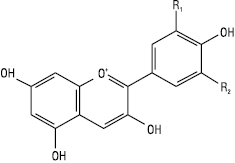
| Назва | R1 C-3´ |
R2 C-5´ |
| Пеларгонідин Ціанідин Дельфінідин Пеонідин Мальвідин Петунідин |
Н ОН ОН ОСН3 ОСН3 ОСН3 |
Н Н ОН Н ОСН3 ОН |
Флаванони
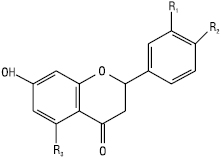
| Назва | R1 C-3´ |
R2 C-4´ |
R3 C-5 |
| Ліквіритигенін Нарингенін Еріодиктіол Гомоеридиктіол Гесперетин |
Н Н ОН ОСН3 ОН |
ОН ОН ОН ОСН3 ОСН3 |
Н ОН ОН ОН ОН |
Флаваноноли
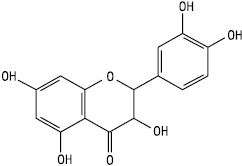
3,5,7,3′,4′ — Пентаоксифлаванонол (дигідрокверцетин)
Флавони
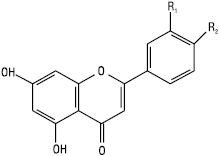
| Назва | R1 | R2 |
| Хризин Апігенін Акацетин Лютеолін Хризоеріол Діосметин |
Н Н Н ОН ОСН3 ОН |
Н ОН ОСН3 ОН ОН ОСН3 |
Флавоноли
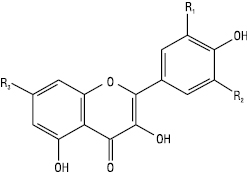
| Назва | R1 C-3´ |
R2 C-5´ |
R3 C-7 |
| Кемпферол Кверцетин Ізорамнетин Мірицетин Рамнетин |
Н ОН ОСН3 ОН ОН |
Н Н Н ОН Н |
ОН ОН ОН ОН ОСН3 |
Халкони
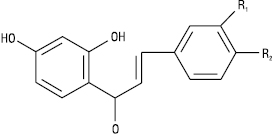
| Назва | R1 | R2 |
| Бутеїн Ізоліквіритигенін |
ОН Н |
Н ОН |
Аурони
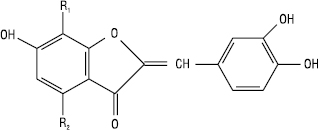
| Назва | R1 | R2 |
| Сульфуретин Ауреузидин Лептозидин |
Н ОН Н |
Н Н ОСН3 |
Ізофлавони
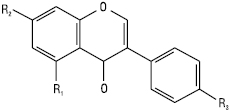
| Назва | R1 C-5 |
R2 C-7 |
R3 C-4’ |
| Геністеїн Формононетин Прунетин Біоханін Ізоформононетин |
ОН Н ОН ОН Н |
ОН ОН ОСН3 ОН ОСН3 |
ОН ОСН3 ОН ОСН3 ОН |
Ф. рідко зустрічаються у вільному стані: пилок квіток містить кверцетин; у корі дерев містяться катехіни, лейкоантоціанідини. Більшість Ф. представлені глікозидами. Частота і перевага заміщення будь-якого положення залежить від структури аглікону. Так, напр., у флавонів заміщення відбувається в положенні С-7, рідше — у С-3′, С-4′; у С-глікозидів — у С-6, С-8. У флавонолів зазвичай заміщення відбувається в положенні С-3 або С-7. Цукрові залишки представлені D-глюкозою, D-галактозою, D-ксилозою, L-рамнозою, L-арабінозою, D-глюкуроновою та D-галактуроновою кислотами. Здебільшого у Ф. глікозидах цукрові залишки зв’язані з агліконами напівацетальним зв’язком через атом кисню. О-глікозиди залежно від кількості та положення цукрових залишків можуть бути монозидами, біозидами, диглікозидами, тріозидами. Цукровий ланцюг може бути лінійним або розгалуженим.
Фізико-хімічні властивості. Ф.: кристалічні сполуки з певною Тпл. Катехіни, флавани, ізофлавани, флаванони, лейкоантоціанідини, флаванони — безбарвні кристали; флавони, флавоноли, халкони, аурони жовті або оранжеві. Антоціани змінюють колір залежно від рН-середовища: у кислому вони мають відтінки червоного або рожевого кольору, в лужному — синього або блакитного. Аглікони Ф. розчиняються в діетиловому ефірі, ацетоні, спиртах, але практично не розчиняються у воді. Глікозиди Ф. розчиняються в розбавлених спиртах, гарячій воді. Флаваноли (катехіни) оптично активні. Так, катехін існує в 4 ізомерах, які відрізняються напрямком, кутом обертання (D-катехін, L-катехін, D- та L-епікатехіни) і біологічною дією. Напр., L-епікатехін має Р-вітамінну активність, тоді як інші її не мають. Флаванони і флаваноноли — лабільні сполуки. Під дією окиснювальних реагентів вони можуть переходити в халкони і лейкоантоціанідини відповідно. Ф. О-глікозиди підлягають кислотному, лужному та ферментному гідролізам. Так, при нагріванні 3-О-глікозиди легко гідролізуються зі слабкими мінеральними кислотами з концентрацією 0,1–1%. Для гідролізу 7-О-глікозидів необхідне нагрівання протягом декількох годин з 5–10% мінеральними кислотами, але за наявності лугів легше проходить гідроліз. Гідроліз С-глікозидів здійснюють сумішшю Кіліані (суміш концентрованої хлористоводневої та льодяної оцтової кислот).
Ф. широко розповсюджені в рослинному світі, значно менше зустрічаються в мікроорганізмах та комахах. Ф. знайдені в зелених водоростях, а також були виділені з крил мармурово-білого метелика.
Найбагатші на Ф. родини бобових, гречкових, айстрових, розових. Ф. накопичуються здебільшого в квітках, листі, менше — у стеблах, кореневищах, коренях. Вміст їх коливається від 0,1 до 20% (напр. в пуп’янках софори японської) і змінюється залежно від фази вегетації рослини. Максимальна кількість Ф. відзначається під час цвітіння, а потім зменшується. На їх вміст у рослинах впливають зовнішні фактори. Кількість Ф. зростає зі збільшенням інтенсивності сонячного світла, висоти над рівнем моря. Глікозиди зустрічаються в тканинах активного росту (листі, пуп’янках, квітках), аглікони — у здерев’янілих тканинах (корі, корінні). Найбільш розповсюджені в природі флавоноли. Вони становлять 40% усіх Ф. Так, рутин, напр., виявлений у понад 70 видах, які належать до 34 родин. Кверцетин зустрічається в понад 400 видах рослин. У природі відомо 22 антоціанідини, але широко розповсюджені лише 3 з них: пеларгонідин, дельфінідин, ціанідин. Антоціанідини впливають на колір квіток та листя. Забарвлення більшості плодів зумовлено тільки трьома антоціанами та їх сумішами: ціанідин забарвлює яблука, вишні, малину, червону смородину; дельфінідин — гранат, баклажани; пеларгонідин — суницю, плоди пасифлори; ціанідин з дельфінідином — чорну смородину, апельсини. Халкони і аурони легко виявити в пелюстках квіток — під дією парів аміаку їх колір змінюється з жовтого на червоний. Їх розповсюдження обмежено 9 родинами. Якщо Ф. розчиняються в клітинному соці рослин і знаходяться в хлоропластах клітин, то аурони череди трироздільної знаходяться в молочниках. Флавоноли і флавони знаходяться в епідермісі. Ізофлавоноїди переважно накопичуються в підземних органах і насінні.
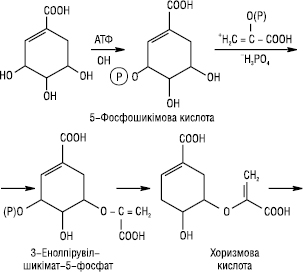
Біосинтез Ф. проходить змішаним шляхом. Кільце А утворюється ацетатним шляхом, кільце В — через шикімову кислоту. Шикімова кислота за участю АТФ фосфорилюється в 5-фосфошикімову кислоту, яка, з’єднавшись з фосфоенолпіровиноградною кислотою, утворює 3-енолпірувілшикімат-5-фосфат, а потім хоризмову кислоту. Остання внаслідок перегрупування в молекулі перетворюється на префенову кислоту. Префенова кислота є проміжною сполукою в біосинтезі Ф., кумаринів, ароматичних амінокислот та інших поліфенолів. Префенова кислота амінується й разом з тим декарбоксилюється, внаслідок чого може утворитися фенілаланін або тирозин. Дезамінування останніх приводить до появи коричної та n-кумарової кислоти відповідно:
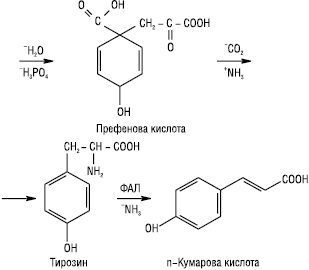
Триоцтова кислота реагує з n-кумаровою кислотою. Внаслідок їх конденсації, циклізації та енолізації утворюється халкон.
Для виділення Ф. з рослинної сировини використовують нижчі спирти: етанол, метанол. Спиртові витяжки випарюють до водного залишку, розводять водою й обробляють хлороформом для відокремлення ліпідів та ліпоїдів, хлорофілу, каротиноїдів, восків, жирної олії та ін. Очищений водний залишок послідовно обробляють діетиловим ефіром, етилацетатом, пропанолом, бутанолом, тобто одержують фракції агліконів, монозидів, біозидів, тріозидів відповідно. Таке послідовне екстрагування Ф. розчинниками з поступово зростаючою полярністю називається фракціонуванням. Для розділення Ф. на індивідуальні компоненти використовують колонкову хроматографію на силікагелі, поліаміді, целюлозі. Колонку елююють сумішшю хлороформу і спирту, поступово збільшуючи частку спирту в суміші.
Ідентифікація Ф. Специфічна реакція на Ф. — ціанідинова проба. Часто її виконують у модифікації Сінода. Суть реакції полягає в утворенні продуктів відновлення воднем при взаємодії металічного Mg та концентрованої хлоридної кислоти, внаслідок чого утворюються антоціанідини:
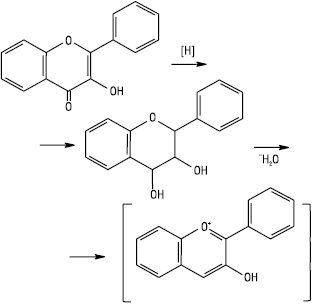
Халкони та аурони ціанідинової реакції не дають, але з концентрованою хлоридною кислотою утворюють червоне забарвлення за рахунок утворення оксонієвих солей. При цьому глікозиди дельфінідину дають синьо-червоне забарвлення, ціанідину — яскраво-червоне, а пеларгонідину — оранжево-червоне. Ізофлавони, флавони дають жовте забарвлення, іноді — червоне. Флаванони — від малинового до яскраво-червоного.
Основні реакції ідентифікації Ф.
З борнолимонним реактивом. 5-оксифлавони і 5-оксифлавоноли з борною кислотою за наявності лимонної або щавлевої кислоти утворюють комплекс яскраво-жовтого кольору з жовто-зеленою флуоресценцією:
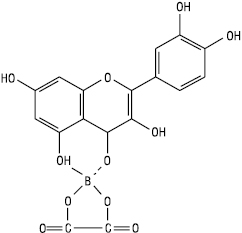
Таубек описав реакцію за наявності щавлевої кислоти; б) Вільсон використав ацетоновий розчин борної й лимонної кислот. 3-оксифлавони без -ОН при С-5 не дають цієї реакції.
З п’ятихлористою сурмою в чотирихлористому вуглеці Ф. утворюють червоне або оранжеве забарвлення. Це пояснюється тим, що SbCl5 є сильною кислотою льюїсівського типу. Вона діє як сульфатна кислота і викликає подібний галохромізм. Халкони дають червоне, червоно-синє забарвлення; флавони — жовте, оранжеве. Дигідрохалкони, в яких відсутній спряжений подвійний зв’язок між карбонільною групою та кільцем В, не дають забарвлення з SbCl5.
Азосполучення. З діазотованим сульфаніламідом Ф., які мають вільну гідроксильну групу в положенні С-7, утворюють забарвлені продукти азосполучення. Флавони, флавонони, флавоноли, флавононоли дають оранжеве забарвлення з розчином аміаку. Халкони та аурони мають червоно-пурпурове забарвлення.
З розчинами лугів. З теоретичної точки зору, забарвлення не повинні утворювати з розчинами лугів Ф., які не мають карбонільних груп (катехіни, лейкоантоціани), або в яких відсутній подвійний зв’язок між гідроксильною та карбонільною групами (флавононоли). Але практично всі ці сполуки утворюють забарвлення з лугами завдяки вторинним перетворенням. Напр., катехіни дають жовтий та червоний колір внаслідок утворення невеликої кількості продуктів їх окиснення, тому що вони чутливі до кисню повітря. Флаванони при взаємодії з розбавленими лугами дають безбарвні або жовтуваті розчини, які з часом стають яскраво-жовтими або червоними внаслідок їх ізомеризації в халкони. Халкони та аурони одразу утворюють з лугами червоні та пурпурові розчини. Флавони і флавоноли утворюють з лугами жовте забарвлення, а поліоксифлавоноли (шість та більше груп) дають червоні або сині розчини.
З концентрованою сульфатною кислотою. Багато Ф. розчиняються в сульфатній кислоті й утворюють забарвлені розчини. Флавони та флавоноли утворюють при цьому оксонієві (флавілієві) солі такої загальної будови:
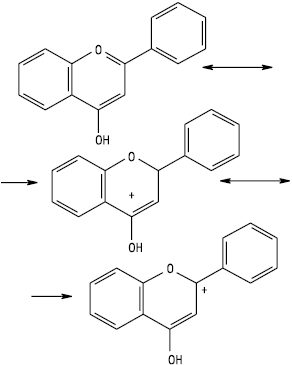
Флаванони утворюють у сульфатній кислоті яскраво-оранжеве або червоне забарвлення, що зумовлено появою солей відповідних халконів, які мають спряжені подвійні зв’язки в іонах:
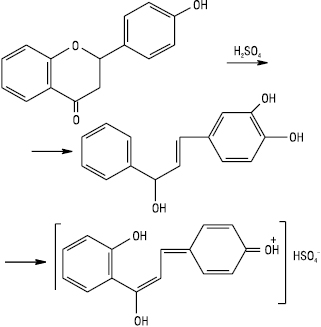
Халкони та аурони з сульфатною кислотою утворюють інтенсивне забарвлення від червоного до малинового кольору, що пояснюється також появою хіноїдних структур.
Деякі флаванони розчиняються в нітратній кислоті й утворюють яскраво-синє забарвлення. Реакція негативна для флавонів та халконів. З розчином ваніліну в концентрованій хлоридній кислоті катехіни дають червоно-малинове забарвлення.
При взаємодії з середнім ацетатом свинцю дають осад Ф., які мають діортооксиугруповання в кільці В:
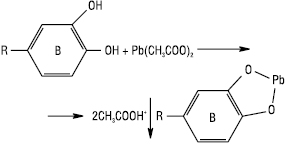
Антоціани утворюють осад синього кольору. Колір осаду з флавонами — оранжевий, з ауронами — червоний, з антоціанами — червоний або синій.
Для поділу і виявлення Ф. використовують паперову хроматографію (ПХ) і хроматографію в тонкому шарі сорбенту (ТШХ). У фільтрованому УФ-світлі при довжині хвилі 360 нм Ф. здатні флуоресціювати. Флавони, флавонол-3-глікозиди, флаванони, халкони флуоресціюють темним і темно-коричневим кольором; флавоноли та їх глікозиди — жовтим, жовто-зеленим; аурони — коричневим; ізофлавони — не проявляються; птерокарпани — світло-блакитним; куместани — яскраво-блакитним, бірюзовим. Хроматограми звичайно проявляють хромогенними реактивами, які використовують для якісних кольорових реакцій. Це спиртові розчини лугів, гідрокарбонату натрію, алюмінію хлориду, пари аміаку та ін.
Для кількісного визначення Ф. запропоновано багато методів: вагові, об’ємні (потенціометричне титрування в неводних середовищах, комплексометричне титрування), флуорометричні, полярографічні, фотоколориметричні. Але найбільшого поширення набув спектрофотометричний метод. Він базується на реакціях комплексоутворення з іонами різних металів, реакції азосполучення, з борною кислотою з наступним визначенням оптичної густини в УФ-світлі при відповідній довжині хвилі.
Існує кілька версій про значення Ф. у життєдіяльності рослин. По-перше, вони беруть участь в окисно-відновних процесах, виконуючи антиоксидантну функцію; по-друге, поглинаючи УФ-світло, запобігають руйнуванню хлорофілу; по-третє, беруть участь у процесі запліднення. Великий інтерес учених і практиків до вивчення флавоноїдних сполук та ЛРС, яка містить ці речовини, пояснюється різноманітністю їх фармакологічної дії та низькою токсичністю.
Фармакологічна активність Ф. Такі Ф., як квертецин, кверцитрин, катехін, антоціани, збільшують амплітуду серцевих скорочень, нормалізують серцевий ритм. С-С-глікозиди флавонів (вітексин та ін.), гіперозид діють як судинорозширювальні препарати, викликаючи гіпотензивний ефект. Спазмолітичну дію зумовлюють халкони, флаванони (ліквіритин), флавоноли (кверцетин, рутин), флавони (апігенін). Діуретичну дію має лютеолін; високу гіпоазотемічну — робінін та інші похідні кемпферолу. Ф. мають радіопротекторну дію, виводять радіонукліди. Встановлена протипухлинна дія лейкоантоїанідинів: лейкопеларгонідину, лейкодельфінідину, лейкоціанідину. Катехіни виявляють в’яжучу і протизапальну дію. Останнім часом установлена гіпоглікемічна дія Ф. Вітамін Р об’єднує різні фенольні сполуки, здатні знижувати проникність і крихкість капілярів, підвищувати їх резистентність. Це пояснюється тим, що вітамін Р здатний знижувати рівень гіалуронідази, запобігати окисненню аскорбінової кислоти і адреналіну. Р-вітамінну активність мають флавони: гесперидин, еріодиктин; флавоноли: рутин, кверцитрин, ізокверцетин, кверцетин, ізорамнетин; катехіни: L-епікатехін; гідроксикумарини: ескулін, ескулетин. Ізофлавоноїди мають естрогенну та анаболізувальну дію.
Георгиевский В.П., Комиссаренко Н.Ф., Дмитрук С.Е. Биологически активные вещества лекарственных растений. — Новосибирск, 1990; Литвиненко В.И. Природные флавоноиды. — Х., 1995; Cody V., Middleton E. Jr., Harborne J.B. & Beretz A. (eds.) — Progress in Clinical and Biological Research, 1988. — Vol. 280, Plant Flavonoids in Biology and Medicine II: Biochemical, Cellular and Medicinal Properties, Alan R. Liss, Inc.; Cushman M., Nagarathnam D., Burg D.L. & Geahlen R.L. Synthesis and protein-tyrosine kinase inhibitory activities of flavonoid analogues // J. Med. Chem. — 1991. — 34; Kuppusamy U.R., Khod H.E. & Das, N.P. Structure-activity studies of flavonoids as inhibitors of hyaluronidase // Biochem. Pharmacol. — 1990. — № 40.
