КУМАРИНИ (фр. coumarine) (2Н-[1]-бензопіран-2-они, 2H-хромен-2-oни, бензо[b]пірон-2) — природні сполуки, в основі будови яких лежить бензо-α-пірон. З хімічної точки зору К. — це лактони цис-o-гідроксикоричної (кумаринової) кислоти.
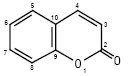
Кумарин
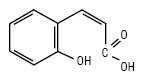
Цис—2-гідроксикорична кислота
К. уперше був виділений Фогелем у 1820 р. із бобів тонка (лат. Dipterix odorata Wild., род. Fabaceae), які містять до 1,5% К.
Чистий К. — безбарвна кристалічна речовина гіркого смаку з ароматом свіжого сіна (людина відчуває запах К. у концентрації 1,72·10–9 г/л); Tтопл. — 70 оС, Tкип. — 291 оС, Tспал. — 151 оС, межа спалаху — 88 г/м3; розчиняється в етанолі 8% (при 20 °С), розчиняється у діетиловому ефірі, ефірних оліях, погано розчиняється у воді (0,3% при 20 оС); у розчинах лугів утворює сіль цис—2-гідроксикоричної кислоти. ЛД50 0,29–0,68 г/кг (миші, per os); на світлі димеризується у дикумарин. Уперше К. синтезований Перкіним (старшим) шляхом конденсації саліцилового альдегіду з оцтовим ангідридом у присутності ацетату натрію (1868). Перша класифікація К. була створена Е. Шпетом у 1937 р. і деталізована Г.О. Кузнецовою у 1967 р. З того часу відслідковується стійка тенденція до зростання кількості публікацій з хімії К. На початок 2007 р. у базі даних CAS REGISTRY інформаційної служби «Chemical Abstracts Service» зареєстровано близько 100 тис. сполук, що мають 2H-[1]-бензопіранову структуру. Кожного року лише із синтезу К. з’являється близько 10 патентів і публікується 60–80 статей у провідних хімічних журналах світу.
Природні К. класифікують на такі групи: 1) прості К. (гідрокси-, метокси-, С-алкіл- або алкоксипохідні) та їх глікозиди:
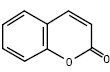 |
R5 | R6 | R7 | R8 |
| Кумарин | Н | Н | Н | Н |
| Умбеліферон | Н | Н | ОН | Н |
| Герніарин | Н | Н | ОСН3 | Н |
| Скімін | Н | Н | О–Glu | Н |
| Ескулетин | Н | ОН | ОН | Н |
| Ескулін | Н | О–Glu | ОН | Н |
| Скополетин | Н | ОСН3 | ОН | Н |
| Скопарон | Н | ОСН3 | ОСН3 | Н |
| Скополін | Н | ОСН3 | О–Glu | Н |
| Дафнетин | Н | Н | ОН | ОН |
| Остол | Н | Н | ОСН3 | 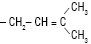 |
| Фраксетин | Н | ОСН3 | ОН | ОН |
| Фраксин | Н | ОСН3 | ОН | О–Glu |
| Фраксидин | Н | ОСН3 | ОСН3 | ОН |
| Ізофраксидин | Н | ОСН3 | ОН | ОСН3 |
| Елеутерозид В1 | Н | ОСН3 | О–Glu | ОСН3 |
| Фраксинол | ОСН3 | ОН | ОСН3 | Н |
2) фурокумарини — сполуки, в яких фурановий цикл лінійно (похідні псоралену) або ангулярно (похідні ангеліцину) конденсований з К. ядром. Щодо замісників, то вони можуть знаходитись в усіх трьох кільцях:
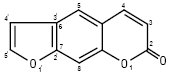
Псорален (фуро-21,31: 7,6-кумарин)
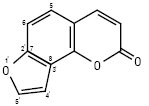
Ангеліцин (фуро-21,31:7,8-кумарин)
| R5 | R8 | Похідні псоралену |
| H | H | Псорален |
| OCH3 | H | Бергаптен |
| H | OCH3 | Ксантотоксин |
| OCH3 | OCH3 | Ізопімпінелін |
| Н | ОСН2СН=С(СН3)2 | Імператорин |
| ОСН2СН=С(СН3)2 | Н | Ізоімператорин |
| Н | О –ОСН2-Δ–(СН3)2 |
Оксипеуцеданін |
3) піранокумарини, або хромено-α-пірони — сполуки, які мають кумаринове ядро конденсоване з пірановим фрагментом за положеннями 5,6; 6,7 або 7,8; вони можуть мати замісники в усіх циклах:
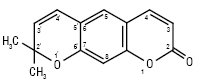
Кантилен, або
21,21-диметилпіран-51,61:6,7-кумарин
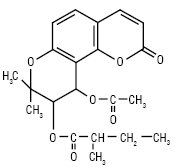
Віснадин
4) бензокумарини — похідні, які містять бензольне кільце, конденсоване з К. у положенні 3,4, напр., елагова кислота (див. Дубильні речовини); 5) куместроли — сполуки, які містять бензофуранову систему конденсовану з К. у положенні 3,4. Перші куместроли були ізольовані з різних видів конюшини (Trifolium) родини бобових.
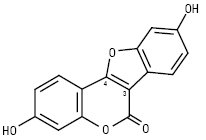
Куместрол
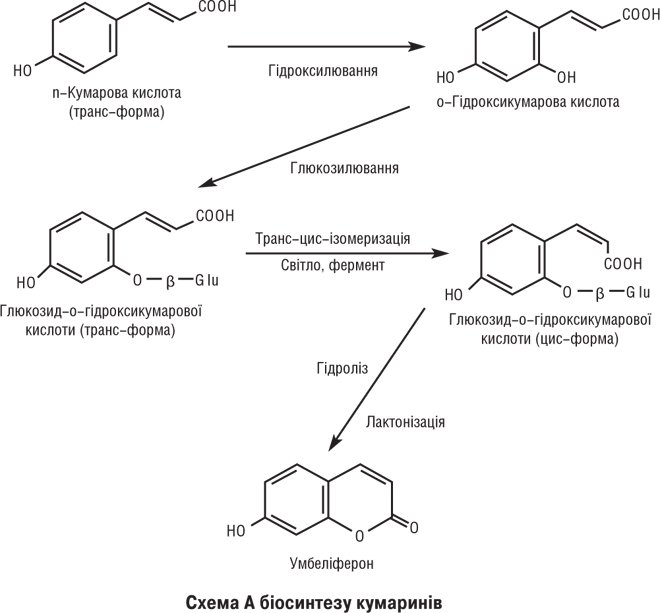
Біосинтез К. у рослинах відбувається за участю шикімової, префенової та гідроксикоричних кислот (див. Гідроксикоричні кислоти); ядро К. утворюється після ферментативного гідроксилювання синтезу глікозидів-попередників з одночасним перетворенням транс-форми у цис-конфігурацію і замиканням лактонного кільця (схема А).
У сполук, які синтезуються з пентакетидного прекурсора через 5-метил-4-гідроксикумарин, лактонне кільце зазвичай містить гідроксильні замісники (схема Б).
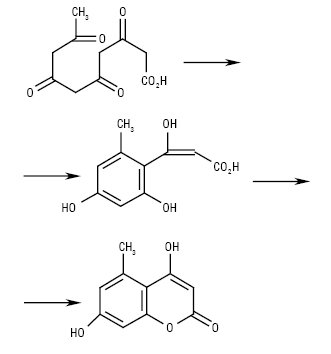
Схема Б. Біосинтез кумаринів
Прикладами сполук з гідроксилом у С-3 є брахікумарин з коренів південноамериканської рослини Brachyclados megalantus, для якого встановлено антибіотичні властивості, та токсичний кумарин феруленол з рослин роду Ferula.
Найбільш поширеними замісниками у молекулах К. є гідроксильна, метоксильна, рідше — метильна групи. Бензо-α-пірони легко димеризуються in vitro під дією сонячного світла та УФ-випромінювання з утворенням ефірного (дафноретин) або С–С зв’язку між С-3 атомами двох К. або сполученням С-4 та С-8 положень різних молекул. Найбільш відомий антикоагулянт — дикумарин (див. Антикоагулянти), який відкрито у 20-х роках XX ст. при пошуку причини численної загибелі худоби від внутрішніх крововиливів. З’ясувалося, що тварин годували травою буркуну (див. Буркун), яка містить цей димер. Більшість рослинних К. є пренільними похідними вищенаведених К. та продуктами подальших перетворень пренілкумаринів. Ізопреноїдні фрагменти, такі, як ізопрен, моно- або сесквітерпеноїди, приєднуються через гідроксильну групу, рідше утворюють С–С зв’язок з фенольним чи лактонним кільцями (див. Ізопреноїди). Вони можуть знаходитися в одному або декількох положеннях молекули, ізомеризуватися; часто має місце гідратація подвійного зв’язку, утворення вільних або етерифікованих гідроксилів, епоксидів або поява кетонної функції. Деякі К. внаслідок циклізації бокових ланцюгів здатні утворювати фуранові або піранові гетероцикли. Відомі О-алкільовані К. містять сесквітерпеноїди циклофарнезанового або біциклофарнезанового рядів. Структура може ускладнюватися за рахунок С-ацилювання різних атомів вуглецю бензольного або піранового кілець, створення глікозидів або глибоких окисних перетворень. Типовий представник першої групи — остол, який поширений серед рослин з родини селерових. Алкільні замісники, відмінні від ізопентильних, трапляються у природних К. досить рідко. Незвичайні кумаринові токсини з 4-алкільними та 4-арильними замісниками, що налічують до півсотні членів, були ізольовані з кісточок тропічних абрикосів (Mammea amtricana, M.africana). Іноді ізопреноїдні ланцюги утворюють димери за реакцією Дильса — Альдера двох дієнів. Піранокумарини утворюються за реакцією циклізації К., які містять вільні гідроксили в орто-положенні до ненасиченого ізопренового ланцюга. Гідроксильні групи виникають шляхом гідратації або гідроксилювання подвійного зв’язку піранового циклу. Зазвичай гідроксильні похідні піранокумаринів утворюють складні ефіри карбонових кислот з невеликою кількістю атомів карбону. Ангулярний піранокумарин називається сеселін. Внаслідок гідроксилювання подвійного зв’язку сеселіну утворюються цис— чи транс-келактони. Серед похідних цис-ряду відомі фізіологічно активні ефіри віснадин та дигідросамідин, які діють спазмолітично та розширюють судини. У глікозидованих формах К. глікан зазвичай представлений глюкозою, яка приєднується у С-6 (скимін), С-7 (ескулін), С-8 (фраксин) К. або до бокового замісника (колумбіанін). Гідроксильні групи К. утворюють складні ефіри з органічними кислотами; виникають сполуки, які називають ацилкумаринами. Часто у природі зустрічаються ацилкумарини з оцтовою, 1,2-диметилакриловою, ізовалеріановою, сенеціоновою, 2-метилмасляною та іншими кислотами. Широко розповсюджені два ізомери 1,2-диметилакрилової кислоти: цис-форма — тиглінова кислота, транс-ізомер — ангелікова кислота. Іноді до ацильного компоненту входить сірка (флороселін, сеселіфлорин). Ацильний фрагмент може утворюватися з двох органічних кислот, напр., пейлустрин. Ацилкумарини — дуже лабільні сполуки, тому виділяти їх з ЛРС досить складно. Фуранокумарини виникають внаслідок циклізації ненасиченого ізопентильного ланцюга пренільованих К. Первинними продуктами є дигідрофуранові похідні, які містять ізопропільну групу. Найбільш відомими є мармезин та його складний ефір дельтонін. При відщепленні ізопропанового фрагменту утворюється псорален. Основними замісниками у фурокумаринах є метоксильні групи; ізопренільні радикали приєднуються за С- або О-зв’язком.
Розповсюдження. Відома структура понад 100 тис. природних та синтетичних К.; їх містять понад 600 видів рослин з 194 родин. Найбільш типові К. для родин селерових, рутових, бобових. У рослинах інших родин (айстрові, гіркокаштанові, пасльонові тощо) К. зустрічаються відносно рідко. Найбільш поширені гідрокси- та метоксипохідні К. та фурокумарину. Чистий К. часто є компонентом ефірних олій (лавандова, корична) та бальзамів (перуанський). Сполуки знаходяться у вільному стані, рідше — у формі глікозидів. Вміст К. у сировині коливається від 0,2 до 10%. Вони накопичуються переважно у плодах, насінні, коренях, корі, квітках і менше — у траві та листі. У родині селерових К. локалізуються в ефіроолійних канальцях. Часто синтезується 5–10 К. в одній рослині. Якісний склад і вміст К. мінливий навіть у різних видів одного роду. Можливі відмінності і всередині одного виду (підвиди, хемоформи). Склад К. змінюється також в онтогенезі рослин. К. відіграють роль ендогенних регуляторів росту рослин. У малих концентраціях К. посилюють ріст рослин, а у великих, навпаки, уповільнюють. Напр., скополетин забезпечує інгібування проростання та біохімічної активності бульб картоплі. Крім того, він має протимікробну та фунгітоксичну активність, що захищає бульби від фітопатогенних мікроорганізмів. З’ясовано, що цей К. синтезують також корені вівса, звідки він потрапляє у грунт, де гальмує ріст бур’яну завдяки алопатичним властивостям.
Заготівля ЛРС, яка містить К., має особливості, пов’язані з фотосенсибілізувальною активністю фурокумаринів. Сировину збирають зранку або у похмурі дні для запобігання фотодинамічному опіку у заготівельників. Сушити сировину потрібно швидко, особливо якщо вона містить глікозиди. Запах свіжого сіна, характерний для кумарину, з’являється внаслідок ферментації глікозидів під час сушіння. При подрібненні сухої сировини захищають дихальні шляхи.
К. і фурокумарини — кристалічні, безбарвні або злегка жовті сполуки. При нагріванні до 100 оС сублімуються. К. добре розчиняються в органічних розчинниках, етиловому та метиловому спиртах, жирах, жирних та ефірних оліях; глікозиди К. малорозчинні у воді. К. розчиняються також у водних лужних розчинах (особливо при нагріванні) за рахунок утворення солей гідроксикоричних кислот. Кристали деяких К., спиртові розчини та плями на хроматограмах залежно від структури мають характерну флуоресценцію в УФ-світлі: блакитну, синю, фіолетову, зелену або жовту, яка посилюється після обробки лугом. Сульфатна кислота збуджує флуоресценцію К. з порушеним сполученням карбонілу з бензольним циклом. Для виділення К. з рослинної сировини застосовують екстракцію (комбінування розчинників) спиртом, хлороформом, бензолом, діетиловим або петролейним ефіром. На практиці К. екстрагують метанолом або етанолом. Одержаний після відгонки спирту густий екстракт обробляють розчинниками: петролейним ефіром, бензолом та хлороформом. Інколи рослинну сировину обробляють ефіром, а потім хлороформом, етиловим і метиловим спиртами. На стадії промислового одержання К. рекомендується очищати екстракти активованим вугіллям для звільнення від ліпофільних сполук. Для розділення суми К. на індивідуальні сполуки застосовують хроматографію на колонках сорбентів: оксиду алюмінію і силікагелю. К. з колонок змивають органічними розчинниками. У сировині К. визначають якісними реакціями та методом хроматографії. К. специфічно реагують з лугами, під дією яких лактонне кільце повільно гідролізує і утворює жовтий розчин солей кумаринової кислоти. При підкисленні лужних розчинів або при насиченні їх СО2 знову утворюється лактонний цикл. На хроматограмах К. визначають за УФ-флуоресценцією, яку порівнюють з результатами реакції азосполучення з діазотованою сульфаніловою кислотою, n-нітроаніліном або сульфаніламідом; у лужному середовищі діазогрупа приєднується до С-6 кумаринової системи. Продукти реакції мають стійке забарвлення — від жовтогарячого до червоного. За реакцією азосполучення К. відрізняють від похідних хромону (бензо-γ-пірону), які мають подібну до К. флуоресценцію, але утворюють світло-жовте забарвлення у розчині; на паперових хроматограмах азосполуки хромонів зовсім не визначаються. На хроматограмах похідні К. визначають за специфічною флуоресценцією в УФ-світлі; далі хроматограми обробляють діазореактивом. При визначенні вмісту К. враховується здатність лактону до розмикання-замикання залежно від рН середовища, що використовується у гравіметричному методі визначення суми К. Реакція К. з лугами лежить в основі методу нейтралізації (зворотного титрування), флуоресценція в УФ-світлі — флуориметричного методу. Спектрофотометричний та колориметричний методи базуються на вимірюванні оптичної густини забарвлених продуктів реакції азосполучення при довжині хвилі максимуму поглинання К. в УФ-сфері спектра. Визначення К. також проводять полярографічним методом.
Застосування К. базується на великій різноманітності біологічної дії на тварин та людину. Чистий К. виявляє наркотичну дію на земляних хробаків та кролів, седативну та гіпнотичну — на мишей, є отрутою для риб, овець, собак та коней. Фурокумарини (псорален, бергаптен, ксантотоксин та ін.) виявляють фотодинамічну активність. У темряві вони інертні, але активуються під дією сонячного світла або УФ-променів та стають цитотоксичними. Найбільшу активність виявляє ксантотоксин: у концентрації 10–10 моль/л та освітленні він токсичний для лейкоцитів людини. Здатність фурокумаринів підвищувати чутливість шкіри на світлі знаходить застосування у комплексній терапії вітиліго, псоріазу, лейкодермії; робляться спроби лікування лейкозів ксантотоксином, який активований світлом. Імператорин має протиалергічні властивості. Деякі К. виявляють спазмолітичну та коронаророзширювальну дію, напр., піранокумарини із коренів здутоплідника (див. Здутоплідник сибірський), атамантин із коренів і плодів смовді гірської (Peucedanum oreoselinum), птериксин із жабриці cкупченої (Seseli condensatum), пастинацин із плодів пастернаку (див. Пастернак). Установлено, що функцію фітоалексину у пастернаку виконує ксантотоксин, а у цитрусових — скопарон. К. з роду Mammea — потенційні інсектициди. Ескулетин, фраксетин та їх глікозиди ескулін і фраксин із плодів гіркокаштану (див. Гіркокаштан) мають Р-вітамінну дію (див. Рутин); умбеліферон — антимікробну; дикумарин є першим антикоагулянтом непрямої дії, від якого походять неодикумарин та інші похідні 4-оксикумарину. Етилбіскумацетат (неодикумарин, пелентан), синкумар, феніндіон, варфарин порушують у печінці синтез факторів згортання крові за рахунок антагонізму з вітаміном К, необхідним для утворення протромбіну у печінці. Діють повільно та довготривалий час; активність та ступінь кумуляції залежать від хімічної будови. Крім того, вони підвищують проникність капілярів, знижують рівень ліпідів у крові; несумісні з α- та β-адреноміметиками, антидепресантами, естрогенами, саліцилатами тощо. Дію посилюють інгібітори МАО. Синтетичний К. варфарин є активним компонентом зоокумарину — отрути для пацюків, завдяки кумуляції якого дія наступає на 3–5-ту добу і триває 3–5 днів після вживання. Кумаринову природу має один з найсильніших мікотоксинів — афлатоксин В1. Залежно від виду тварин його LD50 становить 0,35–10 мг/кг. Токсин руйнує клітини печінки, а в мінімальних дозах (0,015 мг/кг пацюків) індукує утворення злоякісних пухлин, які визначають через тривалий час. Остол підвищує тиск крові, стимулює дихання, виявляє антибактеріальну та іхтіоцидну активність. Антибіотик новобіоцин, або 3-аміно-4-гідроксизаміщений кумариновий глікозид, який виробляють деякі види бактерій Streptomyces, застосовують при стафілококових інфекціях, остеомієліті тощо. В експерименті на тваринах метильні, метоксильні та гідроксильні похідні К. виявили антигельмінтну активність; вони перспективні для створення засобів лікування трихомонадного кольпіту, паразитарних хвороб шкіри. Однак широкого застосування у медицині К. не одержали через їх токсичні властивості та низьку біодоступність за рахунок малої розчинності у воді. Встановлено, що при освітленні ділянок шкіри з нанесеним на неї кремом для засмаги фурокумарини проявляють канцерогенні та мутагенні властивості. При поглинанні квантів УФ-променів молекули К. збуджуються і реагують з біологічно активними сполуками, які містять подвійний зв’язок, у першу чергу з нуклеїновими основами ДНК клітин. Тому використання К. як фотодинамічних засобів у побуті заборонено. У техніці та народному господарстві К. знайшли використання як оптичні вибілювачі, люмінесцентні барвники для штучних волокон, флуоресцентні індикатори рН, біологічні маркери, активні середовища для лазерів, колектори сонячної енергії, у гальваніці — добавки для утворення блискучих поверхонь. Серед природних і синтетичних похідних К. досліджені родентициди, парфумерні й косметичні ароматизатори. Для ароматизації харчових продуктів К. заборонені.
Кузнецова Г.А. Природные кумарины и фурокумарины. — Л., 1967; Растительные лекарственные средства / Н.П. Максютина, Н.Ф. Комисаренко, А.П. Прокопенко и др. — К., 1985; Семенов А.А. Очерк химии природных соединений. — Новосибирск, 2000; Химическая энциклопедия. В 5 т. — М., 1990; Пименов М.Г. Перечень растений — источников кумариновых соединений. — Л., 1971; Машковский М.Д. Лекарственные средства. — 15-е изд. — М., 2005.
