КРІОСКОПІЯ, кріометрія (грец. κrýos — холод, мороз + scopia — дослідження, огляд) — метод дослідження властивостей розведених розчинів, що базується на вимірюванні температури їх замерзання. Запропонований Ф. Раулем у 1882–1888 рр. Методом К. вивчають залежність температури термодинамічної рівноваги тверде тіло — рідина від складу фаз, які перебувають у стані рівноваги. К. застосовують для вивчення дуже розбавлених бінарних розчинів неізоморфних речовин. При затвердінні такого розчину спочатку випадають кристали чистого розчинника, в результаті чого розчин стає більш концентрованим, а температура кристалізації — більш низькою. Тому при визначенні температури затвердіння розчину слід визначити температуру початку кристалізації розчинника. Фактично температурою замерзання розбавленого розчину є температура, при якій замерзає розчинник у розчині даної концентрації. Зниження температури замерзання розбавленого розчину:
∆Тз = Т0з – Тз
або депресія, зростає прямо пропорційно концентрації розчину:
∆Тз = K·m,
де Т0з — температура замерзання розчинника, Тз — температура замерзання розчину; ∆Тз — зниження температури замерзання розчину; K — кріоскопічна стала, т — молярність розчину. Для розчинів електролітів враховують ізотонічний коефіцієнт Вант-Гоффа (і) (див. Ізотонічний коефіцієнт); тоді рівняння набуває вигляду:
∆Тз = і·K⋅m,
де і — ізотонічний коефіцієнт. K чисельно дорівнює зниженню температури замерзання розчину, який містить один моль неелектроліту в 1000 г розчинника (за умови, що утворюється ідеальний розчин, у якому розчинена речовина не дисоціює і не асоціює). Значення K можуть бути розраховані за співвідношенням:
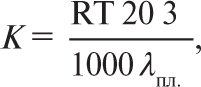
де λпл. — питома теплота плавлення, R — універсальна газова стала.
К. широко використовують для визначення молярної маси розчиненої речовини (М), пов’язаної зі зниженням температури замерзання за допомогою рівняння:

де w1 і w2 — масові частки розчинника й розчиненої речовини відповідно. Для визначення молярної маси речовини попередньо визначають температуру замерзання розчинника, потім після внесення відомої кількості речовини до розчинника — температуру початку замерзання одержаного розчину. Точність визначення маси моля залежить від точності вимірювання температури. Внаслідок необхідності застосування розведених розчинів значення зниження температури замерзання не перевищують декількох десятих градуса, тому для вимірювання температури використовують термометр Бекмана (точність вимірювання температури становить 0,002–0,003°). Зниження температури замерзання може також вимірюватися за допомогою термометра опору — термістора. Цей метод зручний при роботі з невеликою кількістю рідини (0,2–0,5 мл) і застосовується при дослідженні біологічних розчинів (крові, сироватки, сечі тощо) та для контролю температури середовища при заморожуванні біологічних об’єктів. У практиці синтезу і виділення БАР молярну масу визначають за методом Раста, в якому розчинником служить камфора, яка має високе значення кріоскопічної сталої (таблиця).
Таблиця. Кріоскопічні сталі деяких розчинників
| Розчинник | Температура замерзання, К | Кріоскопічні сталі |
| Вода | 273,0 | 1,85 |
| Діоксан | 284,7 | 4,63 |
| Бензол | 278,4 | 5,10 |
| Нітробензол | 278,7 | 6,90 |
| Оцтова кислота | 289,55 | 3,9 |
| Фенол | 314 | 7,3 |
| Камфора | 447,4 | 40 |
Метод К. використовується у фармації для визначення молярної маси БАР та лікарських речовин, ізотонування розчинів, лікарських форм, кількісного визначення вмісту домішок при одержанні речовин, у тому числі біологічно активних і лікарських, з високим ступенем чистоти. За даними К. розраховують осмотичний тиск біологічних та фізіологічних розчинів, ступінь електролітичної дисоціації електроліту та коефіцієнт активності розчиненої речовини. У кріобіології за даними К. визначають евтектичні показники розчинів кріопротекторів. Проведення кріодосліджень необхідне також для експериментального обґрунтування клінічного застосування кріоконсервованих медичних матеріалів і препаратів.
Александров Ю.И. Точная криометрия органических веществ. — Л., 1975; Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. — М. 1990; Фізична та колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін. — Х., 2001; Химическая энциклопедия: В 5 т. — М., 1990. — Т. 2.
