КОНОВАЛОВА ЗАКОНИ встановлюють зв’язок між зміною складу розчину та насиченої пари бінарної системи зі змінами температури або тиску. Перший К.з.: насичена пара порівняно з рівноважним розчином збагачена тим компонентом (В), додавання якого до розчину підвищує тиск насиченої пари над розчином або знижує температуру його кипіння (рис. 1).
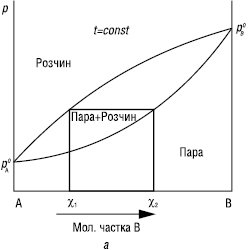
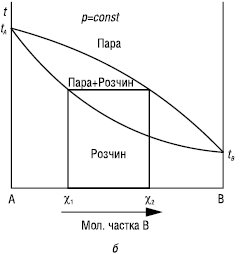
Рис.1. Залежність тиск насиченої пари — склад (а) і температура кипіння — склад (б) для неідеальних розчинів
Другий К.з.: у точках максимуму та мінімуму на кривих загального тиску і температури кипіння склад пари і рівноважного з нею розчину однаковий (χ). Такі розчини називаються азеотропними, або азеотропами (рис. 2).
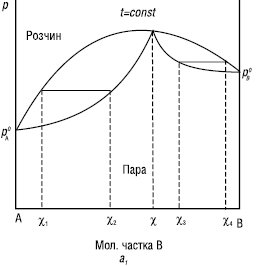
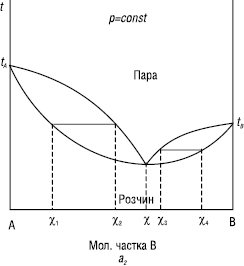
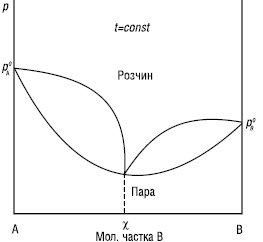
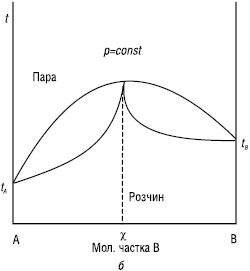
Рис.2. Залежності тиск пари — склад і температура кипіння — склад (б) для систем із значними позитивними (а1, а2) і негативними (б) відхиленнями від закону Рауля
Азеотропи з мінімальною температурою кипіння: вода — етанол, ацетон — метанол, бензол — оцтова кислота та ін. Азеотропи з максимальною температурою кипіння: хлороформ — ацетон, вода — мурашина кислота, вода — фтороводень. Наведені суміші (вода — етанол, вода — ацетон) застосовують для алкаліметричного титрування сульфаніламідів з константою дисоціації 10–7–10–8 (норсульфазол), а також при синтезі багатьох ЛП.
Третій К.з.: при постійній температурі або тиску зміна складу розчину і насиченої пари проходить в одному напрямку (симбатно). К.з. теоретично обґрунтовані та експериментально підтверджені Д.П. Коноваловим у 1881–1884 рр.
К.з. відіграють важливу роль при побудові діаграм фазової рівноваги, за допомогою яких можна теоретично обґрунтувати процес фракційної перегонки (дистиляції) рідких сумішей. Фракційна перегонка — процес розділення розчину, що складається з двох або кількох взаєморозчинних рідин, на чисті компоненти. Фракційна перегонка базується на різниці в складі рівноважних розчину та пари.
На діаграмі (рис. 3) початковий склад розчину визначається точкою χ. Розчин нагрівають до температури кипіння t1. Пара конденсується, перші краплі рідини мають склад χ1. Розчин продовжують кип’ятити, вміст речовини В збільшується доти, поки температура кипіння не стане, напр., t2, а склад — χ2. Останні краплі відігнаної рідини будуть мати склад χ3. Перший конденсат має середній склад у, вміст більш леткого компонента у якому збільшено. Фракційна перегонка — багатостадійний процес. Безперервний процес розділення багатокомпонентних рідин у лабораторних умовах називається дистиляцією, у промисловості — ректифікацією.
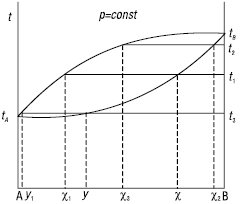
Рис.3. Пояснення ходу фракційної перегонки
Химическая энциклопедия. — М., 1983. — Т. 2; Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін. — Х., 1999.
