КОНДУКТОМЕТРІЯ (лат. conductor — провідник + грец. metreo — вимірюю) — поєднання електрохімічних методів дослідження та аналізу речовин, що ґрунтуються на вимірюванні електричної провідності χ розчинів електролітів, яка пропорційна їх концентрації. Аналітична К. поєднує прямі та опосередковані методи, кондуктометричне титрування.
Прямі методи використовують у тих випадках, коли концентрація речовини, що аналізується, у розчині лінійно пов’язана з електричною провідністю розчину, а концентрації інших компонентів постійні. На методі прямої К. базуються конструкції солемірів та інших кондуктометричних приладів, які дозволяють визначати олеум, різні солі в мінеральній, річковій та морській воді, фізіологічних розчинах. Пряму К. використовують для контролю регенерації іонітів, очищення води, промивання осадів, для визначення чистоти органічних розчинників, газів, твердих солей, ґрунту тощо. Іноді зразки, які аналізують, попередньо спалюють, а гази, що виділяються, поглинають відповідними розчинами. За величиною електричної провідності цих розчинів визначають кількість газів (CO2, NO2, SO2), а внаслідок цього — вміст відповідних елементів, напр., C, N, S у металах, сплавах, органічних сполуках.
В опосередкованих методах, які дозволяють досліджувати суміші електролітів, К. поєднують з іншими фізико-хімічними методами аналізу, що ґрунтуються, напр., на вимірюванні рефракції, рН, в’язкості, густини. Сукупність усіх експериментальних величин дає можливість визначати кількісний склад суміші.
Кондуктометричне титрування побудоване на зміні χ розчину при хімічних реакціях, що пов’язано зі зміною концентрацій іонів різної рухливості. Кондуктометричне титрування проводять у водних, водно-органічних та неводних середовищах. Криві титрування — це залежність χ від об’єму доданого реагенту (титранту) (рисунок), на якій є злом у точці еквівалентності. При титруванні суміші електролітів кількість зломів дорівнює кількості компонентів, що визначаються, які реагують з титрантом.
К. може бути постійного чи змінного струму. В К. постійного струму використовують контактні комірки, в яких електроди з Рt, Ti занурені у середовище, що досліджують. Електроди закріплюють таким чином, що відстань між ними не змінюється під час вимірювання. Для запобігання похибці від електродної поляризації досліджують розведені розчини. Для вимірювання χ розчинів з високою концентрацією електролітів (10–2–10–3 М) використовують платинові електроди з розвиненою поверхнею.
У К. змінного струму низької частоти також використовують контактні комірки, але досліджують розчини в більш широких межах концентрацій. Існує також безконтактна високочастотна К. змінної напруги, в якій використовують ємнісні та індуктивні комірки (див. Високочастотне титрування). На рисунку наведені форми кривих кондуктометричного титрування, яке може базуватися на різних реакціях.
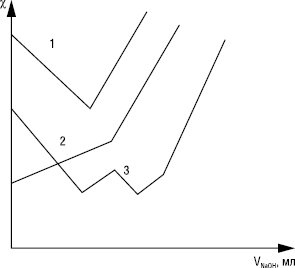
Рисунок. Криві кондуктометричного титрування у контактній комірці розчином NaOH: 1 — HCl; 2 — CH3COOH; 3 — суміші HCl + CH3COOH + (C2H5)3N•HCl + фенол
Найчастіше використовують кислотно-основні взаємодії. Розроблені методи визначення у воді кислот та основ з pK ≤10, солей слабких кислот та основ. При титруванні сильної кислоти сильною основою (крива 1) χ до точки еквівалентності знижується у зв’язку із заміною високорухомих іонів Н+ на менш рухомі іони титранту, а при титруванні слабкої кислоти сильною основою (крива 2) χ до точки еквівалентності збільшується внаслідок дисоціації солі. При надлишку сильної основи після точки еквівалентності концентрація різко змінюється. При титруванні солей χ до точки еквівалентності порівняно мало змінюється, оскільки рухомості іонів, які замінюють один одного, близькі, тому можна проводити аналіз сумішей солей з кислотами та основами, які містять від 2 до 5 компонентів (див. рисунок, крива 3). При кондуктометричному титруванні катіони (напр. Fe2+, Cu2+, Pb2+) титрують етилендіамінтетраацетатом Na, а також тартрат-, оксалат-, цитрат-, ціанід-іонами та ін.
Реакції осадження використовують для кондуктометричного визначення як аніонів, так і катіонів. Напр., розчином AgNO3 відтитровують Cl–, Br–, I–, CN–; розчином Ba(OCOCH3)2 або BaCl2 — SO42–, CrO42–; розчином Th(NO3)3 — F–, SiF62–; розчином Na2SeO3 — Mn2+, Co2+. Методи К., що ґрунтуються на реакціях окиснення-відновлення, використовують дуже рідко.
При так званому хронокондуктометричному титруванні розчин титранту подають в електрохімічну комірку з постійною швидкістю, тому час титрування пропорційний кількості наданого титранту. Концентрацію речовин визначають за кривими «електропровідність розчину — час титрування»; найчастіше виконують автоматичний запис кривих.
Контактні методи мають високу точність. Їх використовують не тільки для хімічного аналізу, а й для вивчення кінетики реакцій, визначення констант іонізації (асоціації) електролітів, розчинності осадів, коефіцієнтів дифузії.
Переваги К.: висока чутливість (нижня межа концентрацій, що визначаються, становить ~10–4–10–5 М), досить висока чутливість (відносна помилка визначення — 0,1–2%), простота методик, доступність апаратури, можливість аналізувати забарвлені та каламутні розчини, а також автоматизація аналізу.
Грилихес М.С., Филановский Б.К. Контактная кондуктометрия. — Л., 1980; Плэмбек Дж. Электрохимические методы анализа. Основы теории и применение. — М., 1985; Худякова Т.А., Крешков А.П. Теория и практика кондуктометрического и хронокондуктометрического анализа. — М., 1976.
