КИСЛОТНО-ОСНОВНЕ ТИТРУВАННЯ (метод нейтралізації) — титриметричний метод аналізу, в основі якого (у водному середовищі) лежить реакція нейтралізації: H3O+ + OH— 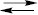 2H2O.
2H2O.
Стандартними розчинами методу є 0,1 М…0,001 М розчини HCl, H2SO4, NaOH, KOH. Якщо як титранти використовують розчини кислот, то метод називають ацидиметрією, а якщо основи — алкаліметрією. Готують вторинні стандартні розчини; їх точну молярну концентрацію встановлюють за стандартними речовинами або при їх титруванні розчинами відомої концентрації. Стандартизацію розчинів кислот проводять за стандартними речовинами: натрію тетраборатом (Na2B4O7⋅10H2O), натрію карбонатом (Na2CO3), трис-(оксиметил)-амінометаном або за стандартними розчинами лугів (NaOH та KOH). Стандартизацію розчинів лугів проводять за стандартними речовинами: оксалатною кислотою (H2C2O4), бурштиновою кислотою (H2C4H4O4), калію гідрофталатом (КНС8Н4О4), калію гідройодатом (КН(IO3)2), за стандартними розчинами HCl, H2SO4.
Залежно від досліджуваного об’єкта використовують різні способи К.-о.т.: пряме, зворотне, замісникове. Кінцеву точку титрування в методі нейтралізації визначають за допомогою кислотно-основних (рН) індикаторів, а також без індикатора — за зміною рН-середовища (потенціометрично) або електропровідності розчину (кондуктометрично). Вибір рН-індикаторів проводять двома способами: за продуктами реакції та за кривими титрування. Обираючи індикатор за продуктами реакції, враховують рН-середовища розчину в кінцевій точці титрування. Якщо рН-середовища >7, то придатним є індикатор, інтервал переходу якого лежить у лужній області значень рН. Напр.: H2C2O4 + 2NaOH 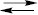 Na2C2O4 + 2H2O (продукт реакції натрій оксалат гідролізує і створює лужне середовище). Для даного визначення використовують фенолфталеїн (інтервал переходу 8,2–10,0 рН). Якщо продукт реакції в кінцевій точці титрування створює кисле середовище (рН <7), то придатним є індикатор, інтервал переходу якого лежить у кислотній області значень рН. Напр.: NaHCO3+HCl
Na2C2O4 + 2H2O (продукт реакції натрій оксалат гідролізує і створює лужне середовище). Для даного визначення використовують фенолфталеїн (інтервал переходу 8,2–10,0 рН). Якщо продукт реакції в кінцевій точці титрування створює кисле середовище (рН <7), то придатним є індикатор, інтервал переходу якого лежить у кислотній області значень рН. Напр.: NaHCO3+HCl 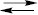 H2CO3+NaCl. Для визначення кінцевої точки титрування в цьому випадку можна скористатись метиловим помаранчевим (інтервал переходу 3,1–4,0 рН). Найбільш придатним є вибір індикатора за кривими титрування. Для цього будують криву титрування, що графічно відображає зміну рН розчину в процесі титрування, для чого придатні індикатори, інтервал переходу яких повністю або частково знаходиться в межах стрибка титрування, тобто індикатори, рН яких входить в межі стрибка титрування. Методом К.-о.т. можна визначати: сильні кислоти та основи; слабкі кислоти та основи (Кі не менше ніж 5⋅10–7); солі, утворені слабкою основою з Кb ≤5⋅10–7 або слабкою кислотою з Ка ≤5⋅10–7; органічні сполуки з кислими або основними властивостями. Кислоти з рКа >7 та основи з pKb <7 титрують з використанням неводних розчинників (див. Неводне титрування). Цим методом можна визначити не тільки індивідуальні речовини, а й суміш різних за силою кислот (основ), суміш солей, що гідролізують, а також суміші солей і кислот (основ). Титрування багатоосновних кислот або багатокислотних основ, суміші кислот (основ), суміші солей, що гідролізують, проводять з урахуванням ступінчастої іонізації або ступінчастого постадійного гідролізу солей, багатоосновних кислот (основ), сили кислот Ка і сили основ Кb, що дає можливість диференційного титрування з фіксуванням декількох точок еквівалентності. Багатоосновні кислоти (основи) можна розглядати як суміші кислот (основ) різної сили внаслідок їх ступінчастої іонізації. Якщо кислоти (основи) значно відрізняються за силою, а відношення констант іонізації K1/K2 ≥104, то кожна з кислот (основ) буде титруватись окремо. Спочатку — найбільш сильна, потім — найбільш слабка. Таким чином, на кривій титрування спостерігають два стрибки титрування. Якщо K1/K2 ≤104, то обидві кислоти (основи) будуть відтитровуватись одночасно, і крива титрування буде мати один стрибок титрування.
H2CO3+NaCl. Для визначення кінцевої точки титрування в цьому випадку можна скористатись метиловим помаранчевим (інтервал переходу 3,1–4,0 рН). Найбільш придатним є вибір індикатора за кривими титрування. Для цього будують криву титрування, що графічно відображає зміну рН розчину в процесі титрування, для чого придатні індикатори, інтервал переходу яких повністю або частково знаходиться в межах стрибка титрування, тобто індикатори, рН яких входить в межі стрибка титрування. Методом К.-о.т. можна визначати: сильні кислоти та основи; слабкі кислоти та основи (Кі не менше ніж 5⋅10–7); солі, утворені слабкою основою з Кb ≤5⋅10–7 або слабкою кислотою з Ка ≤5⋅10–7; органічні сполуки з кислими або основними властивостями. Кислоти з рКа >7 та основи з pKb <7 титрують з використанням неводних розчинників (див. Неводне титрування). Цим методом можна визначити не тільки індивідуальні речовини, а й суміш різних за силою кислот (основ), суміш солей, що гідролізують, а також суміші солей і кислот (основ). Титрування багатоосновних кислот або багатокислотних основ, суміші кислот (основ), суміші солей, що гідролізують, проводять з урахуванням ступінчастої іонізації або ступінчастого постадійного гідролізу солей, багатоосновних кислот (основ), сили кислот Ка і сили основ Кb, що дає можливість диференційного титрування з фіксуванням декількох точок еквівалентності. Багатоосновні кислоти (основи) можна розглядати як суміші кислот (основ) різної сили внаслідок їх ступінчастої іонізації. Якщо кислоти (основи) значно відрізняються за силою, а відношення констант іонізації K1/K2 ≥104, то кожна з кислот (основ) буде титруватись окремо. Спочатку — найбільш сильна, потім — найбільш слабка. Таким чином, на кривій титрування спостерігають два стрибки титрування. Якщо K1/K2 ≤104, то обидві кислоти (основи) будуть відтитровуватись одночасно, і крива титрування буде мати один стрибок титрування.
Метод К.-о.т. застосовують для визначення неорганічних, органічних (у тому числі ЛП) та природних сполук з кислотними та основними властивостями, NO3—, NO2— та NH4+-іонів, складних естерів, гідроксил- та карбонілвмісних груп в органічних сполуках (див. Функціональний аналіз органічних сполук). Має важливе значення визначення деяких елементів в органічних та біологічних системах (C, N, Cl, Br, F, S, P тощо) — елемент, що визначають, переводять у неорганічну кислоту або основу з подальшим визначенням за методом К.-о.т. (див. Визначення нітрогену в органічних сполуках за методом К’єльдаля).
Скуг Д., Уєст Д. Основы аналитической химии — Т. 1, 2. — М., 1979; Аналітична хімія / В.В. Болотов, О.М. Свєчнікова, С.В. Колісник та ін. — Х., 2004.
