Карбонові кислоти (лат. acida carbonica < лат. carbo — вугілля) — похідні вуглеводнів, що містять карбоксильну групу –СООН. За кількістю карбоксильних груп розрізняють моно-, ди- та полікарбонові кислоти; залежно від природи вуглеводневого радикала, з яким зв’язана карбоксильна група, — аліфатичні (насичені, ненасичені), аліциклічні, ароматичні, гетероциклічні К.к. Похідні карбонових кислот, у вуглеводневому радикалі яких один або декілька атомів гідрогену заміщені на інші атоми або групи атомів, напр., на галоген, гідрокси-, аміно-, карбонільну групу та ін., відносять до гетерофункціональних Карбонових кислот (відповідно галогенокарбонові кислоти, гідроксикислоти, амінокислоти, альдегідо- та кетокислоти). Аліфатичні К.к. з числом атомів карбону в молекулі більше 6 належать до вищих жирних кислот.
За замісниковою номенклатурою IUPAC назви монокарбонових кислот утворюють з назв вуглеводнів, відповідних за кількістю атомів Карбону, до яких додається закінчення -ова та слово кислота. Нумерацію починають з атома Карбону карбоксильної групи, напр., СН3СН(СН3)СООН — 2-метилпропанова кислота. Назви дикарбонових кислот утворюють з додаванням множного префікса ди-, закінчення -ова та слова кислота. Іноді назви К.к. утворюють від назви вуглеводню, що містить як замісник карбоксильну групу, та словосполучення карбонова кислота, напр., цикло-С5Н9СООН — циклопентанкарбонова кислота.
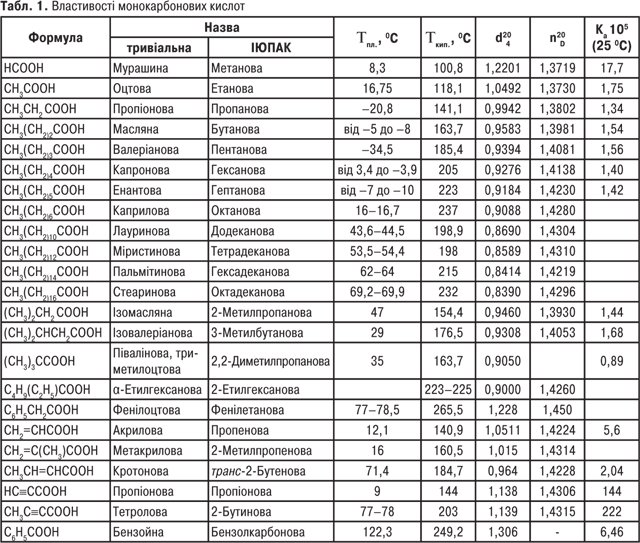
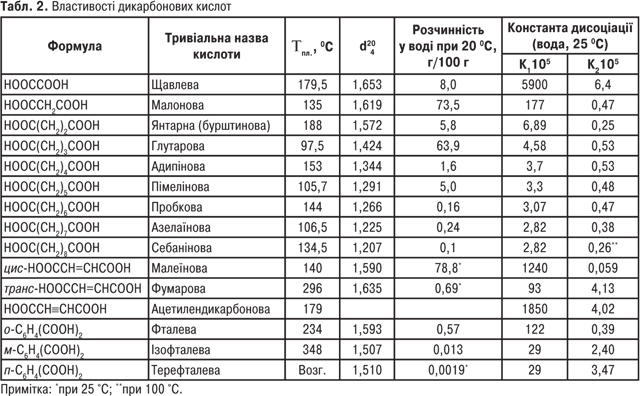
Однак для карбонових кислот частіше використовують тривіальні назви (табл. 1, 2).
Монокарбонові кислоти з числом атомів С1-С3 за звичайних умов рухливі рідини з різким запахом; кислоти з С4-С9 — маслянисті рідини з неприємним запахом; кислоти С10 і вище — тверді речовини (див. табл. 1). Дикарбонові кислоти — білі кристалічні речовини (див. табл. 2). Одноосновні К.к. виявляють слабкі кислотні властивості. У водних розчинах вони дисоціюють з утворенням карбоксилат-аніону та катіону гідроксонію:

Дикарбонові кислоти дисоціюють ступінчасто, утворюючи аніон (K1) і діаніон (K2).
При нейтралізації К.к. лугами утворюються солі:

Солі лужних металів у водних розчинах сильно гідролізовані. К.к. з амоніаком та амінами утворюють амонієві солі, які при нагріванні втрачають воду і перетворюються на аміди:
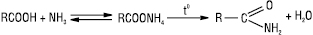
При нагріванні карбонової кислоти зі спиртами в присутності сильних мінеральних кислот отримують естери (реакція естерифікації):
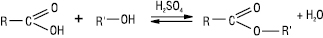
При обробці карбонової кислоти галогенуючими реагентами (PCl3, PCl5, PBr3, PBr5, SOCl2) утворюються галогенангідриди К.к.:

Нагрівання К.к. з сильними водовіднімними речовинами, напр., P2O5, (CF3CO)2O, призводить до утворення ангідридів К.к.:
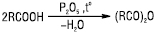
Галогенангідриди, ангідриди, естери, аміди, гідроксамові кислоти, іміди, гідразиди, нітрили відносять до функціональних похідних К.к. Уведення ацильної групи RCO (ацилу) в молекулу органічної сполуки шляхом заміщення атома гідрогену називається ацилюванням. Найпоширенішими ацилювальними реагентами є хлорангідриди, ангідриди К.к. та естери. Ацетилхлорид 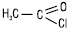 , оцтовий ангідрид (СН3СО)2О широко використовуються в органічному синтезі для ацильного захисту окремих функціональних груп. Промислові методи добування К.к.: каталітичне окиснення (напр. алканів, аренів, альдегідів), гідроліз естерів (з жирів або олії отримують вищі жирні К.к.) або гідрокарболювання (гідрокарбоксилювання) ненасичених вуглевонів чи галогенопохідних вуглеводнів (CO, H2O, Ni(CO)4). У лабораторних умовах К.к. синтезують окисненням первинних спиртів, альдегідів (K2Cr2O7, KMnO4, HNO3 та ін.); гідролізом гемінальних тригалогенопохідних вуглеводнів у кислому або лужному середовищі; гідролізом нітрилів при нагріванні їх з водними розчинами кислот або лугів. Взаємодією магнійорганічних сполук (реактивів Гриньяра) з СО2 одержують солі К.к., з яких у кислому середовищі виділяють відповідні кислоти. К.к. широко використовуються в органічному синтезі: синтезі ЛП (напр. калію ацетат — оцтова кислота, бромізовалу і валідолу — валеріанова та ізовалеріанова кислоти, піперазину адипінат — адипінова кислота, натрію бензоат — бензойна кислота); виробництві вітамінів (пропіонова кислота); у вигляді слабких спиртових розчинів К.к. (мурашина, саліцилова) використовуються як антисептики.
, оцтовий ангідрид (СН3СО)2О широко використовуються в органічному синтезі для ацильного захисту окремих функціональних груп. Промислові методи добування К.к.: каталітичне окиснення (напр. алканів, аренів, альдегідів), гідроліз естерів (з жирів або олії отримують вищі жирні К.к.) або гідрокарболювання (гідрокарбоксилювання) ненасичених вуглевонів чи галогенопохідних вуглеводнів (CO, H2O, Ni(CO)4). У лабораторних умовах К.к. синтезують окисненням первинних спиртів, альдегідів (K2Cr2O7, KMnO4, HNO3 та ін.); гідролізом гемінальних тригалогенопохідних вуглеводнів у кислому або лужному середовищі; гідролізом нітрилів при нагріванні їх з водними розчинами кислот або лугів. Взаємодією магнійорганічних сполук (реактивів Гриньяра) з СО2 одержують солі К.к., з яких у кислому середовищі виділяють відповідні кислоти. К.к. широко використовуються в органічному синтезі: синтезі ЛП (напр. калію ацетат — оцтова кислота, бромізовалу і валідолу — валеріанова та ізовалеріанова кислоти, піперазину адипінат — адипінова кислота, натрію бензоат — бензойна кислота); виробництві вітамінів (пропіонова кислота); у вигляді слабких спиртових розчинів К.к. (мурашина, саліцилова) використовуються як антисептики.
Общая органическая химия: В 12 т. /Под общ. ред. Д. Бартона и У.Д. Оллиса. Карбоновые кислоты и их производные. Соединения фосфора / Под ред. И.О. Сазерленда. — М., 1983 — Т. 4.; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.