ІОНОМІР (рН-метр) — спеціальний електронний аналоговий або цифровий вольтметр з високим вхідним опором або потенціомір з електронним підсилювачем аналогового сигналу, призначений для прямого визначення активності іонів Гідрогену в одиницях водневого показника рН за різницею потенціалів системи електродів, яка складається з індикаторного електрода, оборотного до активності іонів Гідрогену (зазвичай скляного електрода), та хлоридосрібного — як електрода порівняння, занурених у випробовуваний розчин. З метою запобігання виникненню помилок за рахунок поляризації електродів, яка створюється перебігом малих струмів у колі, вхідний опір І. має бути принаймні на два порядки більшим за вихідний опір індикаторного скляного електрода. І. зазвичай повинен забезпечувати чутливість ≤0,05 рН або 0,003 В.
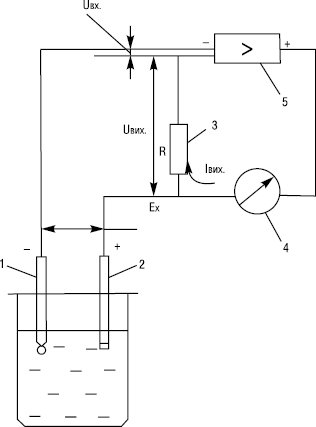
Рисунок. Принципова схема рН-метра: 1 — індикаторний електрод; 2 — електрод порівняння; 3 — резистор; 4 — міліамперметр; 5 — електронний підсилювач.
Робота І. базується на перетворенні різниці потенціалів електродної системи у постійний струм, пропорційний вимірюваній величині. Перетворення різниці потенціалів електродної системи у постійний струм здійснюється високоомним перетворювачем автокомпенсаційного типу. Різниця потенціалів Ех електродної системи (рисунок) порівнюється з падінням напруги на резисторі R, через який проходить струм Івих. підсилювача. Спад напруги Uвих. на резисторі R протилежний за знаком різниці потенціалів Ех, і на вхід підсилювача подається напруга:
Uвх. = Ех — Uвих. = Ех — Івих.. · R.
За умов досить високого коефіцієнта підсилення напруги Uвих. мало відрізняється від різниці потенціалів електродної системи Ех і завдяки цьому струм, який проходить через електроди в процесі вимірювання, вельми малий, а струм Івих., який проходить через резистор R, пропорційний різниці потенціалів електродної системи, а отже, й рН випробовуваного розчину. Для зручності шкалу І. (рН-метра) градуюють в одиницях рН і обладнують спеціальним пристроєм для контролю температури розчину (щоб регулювати величину 2,303 RT). Хоча виміряні рН-метром значення рН рівні — lg аН+ лише для дуже розбавлених водних розчинів, ці величини є вельми корисними характеристиками кислотності розчинів, у т.ч. неводних. При заміні води неводним розчинником збільшується електричний опір розчину, стає менш репродуктивним потенціал електрода, тому рекомендується розглядати кожний розчинник як незалежну систему із власною шкалою кислотності, протяжність якої визначається величиною константи автопротолізу розчинника.
Про практичне використання — див. Потенціометричне визначення рН.
Александров В.В. Кислотность неводных растворов. — Х., 1981; Бейтс Р. Определение рН. Теория и практика. — Л., 1972.
