ІЗОХІНОЛІН (лат. isocholinum < грец. isos — однаковий + хінолін) (бензо[с]піридин), мол. м. 129,16; безбарвна гігроскопічна рідина;
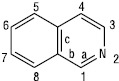
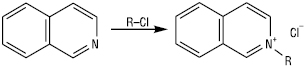
Tпл =26,5 °С, Tкип =243,25 °С, 117–118 °С/17 мм рт. ст.; d254 =1,0990; n25D =1,6208; 5,40 (вода, 20 °С); важкорозчинна у холодній воді, легко — в органічних розчинниках. І. — конденсована ароматична гетероциклічна структура, якій притаманні реакції за участю гетероатома, реакції електрофільного та нуклеофільного заміщення, а також реакції окиснення та відновлення. І. — сильніша основа, ніж хінолін. При протонуванні атома нітрогену ізохінолін утворює солі; з галогенпохідними вуглеводнів та диметилсульфатом утворює відповідні четвертинні солі 2-R-ізохінолінію.
Реакції електрофільного заміщення переважно відбуваються в 5-му положенні: бромування перебігає у присутності AlCl3, дія нітрувальної суміші приводить до утворення 5- та 8-нітрохінолінів, сульфування олеумом при температурі 180 °С приводить до утворення ізохінолін-8-сульфокислоти, сульфування 60% H2SO4 при 300 °С дає суміш ізохінолін-5- та ізохінолін-8-сульфокислот. Нуклеофільне заміщення відбувається переважно за положенням 1: з КОН при 220 °С утворюється 1-гідроксиізохінолін, з NaNH2 (у середовищі рідкого NH3) — 1-аміноізохінолін. При каталітичному гідруванні І. утворюється 1,2,3,4-тетрагідроізохінолін, при повному гідруванні — цис-декагідроізохінолін. Окиснення в рідкій або газовій фазі сумішшю О3 та О2 приводить до утворення піридин-3,4-дикарбонової і фталевої кислот; окиснення надкислотами — до утворення ізохінолін-N-оксиду.
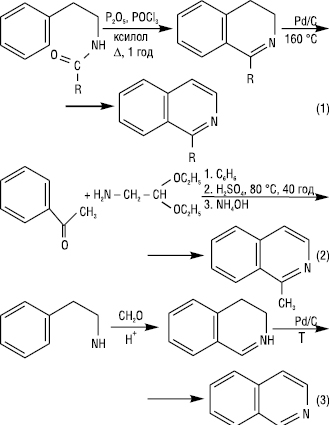
І. виділяють з продуктів дистиляції кам’яновугільної смоли. Синтез І. та його похідних здійснюють циклізацією β-фенілетиламідів з наступним дегідруванням (реакція Бішлера — Напіральського) (1); конденсацією ацетофенону з α-аміноацетацеталем (метод Померанца — Фріча) (2); нагріванням 2-арилетиламіну з надлишком альдегіду у присутності сильних кислот (метод Пікте — Шпенглера) (3):
І. — вихідна сировина у синтезі лікарських речовин і барвників (напр. ізохінолінового червоного). Ядро І. входить до складу ізохінолінових та фенантренізохінолінових алкалоїдів. До них відносять алкалоїди опію: папаверин, морфін, кодеїн та ін.
Джилкрист Т. Химия гетероциклических соединений. — М., 1996; Общая органическая химия: В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. Т. 8. Азотсодержащие гетероциклы / Под ред. П.Г. Сэммса. — М., 1985; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
