ІЗОТОНІЧНИЙ КОЕФІЦІЄНТ (коефіцієнт Вант-Гоффа) використовується при розрахунках ізотонічних концентрацій розчинів електролітів як за законом Вант-Гоффа, так і за рівнянням Менделєєва-Клапейрона. Це пов’язано з тим, що відповідно до закону Вант-Гоффа осмотичний тиск знаходиться в прямолінійній залежності від концентрації розчинених речовин. Лінійна залежність для більшості речовин неелектролітів має місце при концентраціях ≤1·10² моль/л і може бути виражена рівнянням:
P = CRT,
де P — осмотичний тиск, Па; С — концентрація розчиненої речовини моль/л (молярна концентрація може бути замінена на моляльну — моль/кг); R — газова стала; T — температура, °К.
Для розчинів електролітів осмотичний тиск більше розрахованого в і разів. У зв’язку з цим для розчинів електролітів закон Вант-Гоффа має таке значення:
P = і CRT,
де і — ізотонічний коефіцієнт (і>1), який показує, у скільки разів збільшується кількість часток при дисоціації порівняно з недисоційованою речовиною. Він обчислюється за формулою:
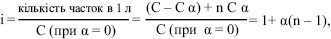
де α — ступінь електролітичної дисоціації — відношення числа молекул, що розпались на іони, до загального числа розчинених молекул залежить від природи розчиненої речовини та розчинника, концентрації розчину (при розведенні розчину ступінь дисоціації збільшується) та температури; n — число часток, що утворюються з однієї молекули речовини при дисоціації. Якщо α=0 (розчин неелектроліту) — і=1, а при α=1 (розчин електроліту, що повністю дисоціює) — і=n. Якщо n=2, то і=1+α. Отже, для натрію хлориду (при дисоціації NaCl утворюються дві частки — іон Na+ та іон Cl–) і йому подібних бінарних електролітів з однозарядними іонами і=1,86, підставляючи у формулу (3) значення α=0,86 (береться з таблиць) та n=2, одержують: і=1+0,86(2 — 1); і=1+0,86=1,86, а для бінарних електролітів з двозарядними іонами (CuSO4, MgSO4, ZnSO4 та ін.), для яких α=0,5, n=2, і=1,5:
і=1+0,5·(2—1)=1,5.
Для кальцію хлориду і подібних йому тринарних електролітів (Na2SO4, MgCl2, Na2HPO3 та ін.), для яких n=3 та α=0,75 одержують і=2,5:
і=1+0,75·(3—1)=2,5.
Для слабких електролітів (борна, лимонна кислоти та ін.) α=0,1 та n=2, і=1,1:
і=1+0,1·(2—1)=1,1.
Рівняння Менделєєва — Клапейрона з ізотонічним коефіцієнтом має такий вираз:
Розв’язуючи рівняння, знаходять m:
m=PVM/іRT=7,4·1·M / і·0,082·310=0,29M/і.
Напр., для натрію хлориду m=0,29·58,45/1,84=9,06, тобто для приготування 1 л ізотонічного розчину натрію хлориду його необхідно взяти 9,06 г.
Тихонов О.І., Ярних Т.Г. Аптечна технологія ліків.– Х., 1995; Фізична та колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін. — Х., 1999.
