ГІДРОКСИКИСЛОТИ (оксикислоти, гідроксикарбонові кислоти) — органічні сполуки, які містять карбоксильну і гідроксильну групи.
Залежно від природи вуглеводневого радикала виділяють аліфатичні та ароматичні Г. (спиртокислоти, фенолокислоти). Кількість карбоксильних груп у молекулі Г. визначає основність, а загальна кількість гідроксильних груп (враховуючи і гідроксили, які входять до складу карбоксильних груп) — їх атомність. За взаємним положенням гідроксильної та карбоксильної груп в аліфатичних Г. розрізняють α-, β-, γ-, δ-Г. та ін. Для Г. широко застосовують тривіальні назви. Г. — безбарвні густі сиропоподібні рідини або кристалічні речовини, добрерозчинні у воді та органічних розчинниках. Більшість природних Г. містить один або кілька асиметричних атомів карбону й існує у вигляді оптичних ізомерів, вступає в реакції, характерні для карбонових кислот, спиртів, фенолів. Кислотні властивості виражені сильніше, ніж у відповідних карбонових кислот. Г. виявляють низку специфічних властивостей; α-Г. при нагріванні зазнають міжмолекулярної дегідратації та утворюють естери — лактиди (І):
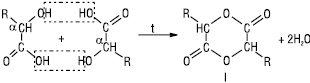
При нагріванні β-Г. у результаті внутрішньомолекулярної дегідратації утворюються α,β-ненасичені карбонові кислоти (ІІ):
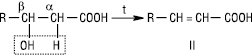
Самовільно або при незначному нагріванні в результаті внутрішньомолекулярної дегідратації γ- і δ-Г. здатні утворювати циклічні естери — лактони (ІІІ):
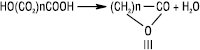
Утворення лактонів Г. з більш віддаленою ОН-групою (понад 7 атомів карбону в ланцюгу) утруднене, відбувається міжмолекулярна естерифікація з виділенням лінійних макромолекул. При кип’ятінні у присутності концентрованої сульфатної кислоти α-Г. розщеплюються на форміатну кислоту і відповідну карбонільну сполуку (альдегід, кетон):
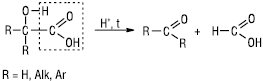
Специфічною властивістю фенолокислот є їх здатність реагувати з галоген-ангідридами фенолокислот з утворенням сполук типу естерів — полідепсидів. При нагріванні фенолокислоти досить легко піддаються декарбоксилюванню. Синтезують Г. гідролізом галогенозаміщених кислот, гідратацією ненасичених кислот, діазотуванням амінокислот, відновленням кетокислот, окисненням гліколів, гідроксіальдегідів, гідролізом оксинітрилів, сплавленням з лугами аренсульфокислот, окисненням гомологів фенолу, в умовах реакцій Реформатського, Кольбе — Шмітта, ціаногідринового синтезу та ін.
Г. відіграють важливу роль у біохімічних процесах, входять до складу багатьох природних сполук. Гліколева кислота — НОСН2СООН, Тпл = 79–80 °С, К 1,48·10–4 (25 °С). Міститься у цукровій тростині. Її солі та естери називають гліколятами і застосовують при фарбуванні шерсті, дубленні шкір, для протравлювання літографічних пластин. Молочна кислота –СН3СН(ОН)СООН.
Для (–) і (+)-форм Тпл = 25–26 °С, для рацемату — 18 °С, К 1,38·10–4 (25 °С). Утворюється при молочнокислому бродінні цукристих сполук (при квашенні капусти, дозріванні сиру та ін.). Солі та естери молочної кислоти називають лактатами. Лактати кальцію та феруму (ІІ) застосовують при дефіциті кальцію в організмі та хронічних анеміях. γ-Оксимасляна кислота — НОСН2СН2СН2СООН.
У вільному стані нестійка, легко утворює лактон. Натрієву сіль γ-оксимасляної кислоти (натрію оксибутират) застосовують як засіб для неінгаляційного наркозу. Яблучна кислота — НOОССН(ОН)СН2СООН.
Для (–) і (+)-форм Тпл = 100 °С, для рацемату — 128 °С. У природі виявляють (–)-яблучну кислоту (у нестиглих яблуках, ягодах горобини, журавлини, малини, барбарису та ін.). Застосовують при виробництві вина, фруктових вод, кондитерських виробів, а також у синтезі ЛП. Винні кислоти — НОOС СН(ОН)СН(ОН)СООН.
Для (+)-кислоти (виннокам’яної, винної) Тпл = 170 °С, К1 1,3·10–3, К2 6,9·10–5 (25 °С). Еквімолярна суміш D(–)- і L(+)-ізомерів (рацемат) називається виноградною кислотою з Tпл = 205 °С, К1 10,2·10–4, К2 4,0·10–5 (25 °С). Мезовинна (антивинна) кислота: Tпл = 140 °С, К1 6,0·10–4, К2 1,4·10–5 (25 °С). У природі існує лише (+)-винна кислота. Утворює кислі (гідротартрати) і середні (тартрати) солі. Гідро-L(+)-тартрат калію KOОССН(ОН) СН(ОН)СООН виділяється у вигляді осаду під час зберігання вина (винний камінь). Тетрагідрат тартрату калію-натрію KOОССН(ОН)СН(ОН) СООNa (сегнетову сіль) використовують для приготування реактиву Фелінга. Винну кислоту також застосовують при консервуванні харчових продуктів, фарбуванні, приготуванні штучних дріжджів, у виробництві дзеркал. Лимонна кислота — НООССН2С(ОН)(СООН)СН2СООН, Тпл = 153,5 °С, К1 8,4·10–4, К2 1,7·10–5, К3 4·10–6 (18 °С). Міститься в ягодах, плодах, хвої, стеблах махорки, а також у молоці та крові. Це один із найважливіших продуктів обміну речовин, який бере участь у циклі Кребса. Її солі та естери називають цитратами. Тринатрієву сіль лимонної кислоти застосовують у медицині як консервант донорської крові. До ненасичених Г. належить рицинолова — СН3(СН2)5СН(ОН)СН2СН = СН(СН2)7СООН, гліцерид якої становить основу рицинової олії. Застосовують для одержання себацинової, ундециленової кислоти, гептаналю, ПАР, емульгаторів тощо. У плодах персика, груші, кавового дерева, у корі хінного дерева міститься аліциклічна Г. — хінна (1,3,4,5-тетраоксициклогексан-1-карбонова кислота), яка є проміжним продуктом у біосинтезі флавоноїдів. Застосовують як засіб проти артриту. Серед ароматичних Г. велике практичне значення має саліцилова кислота — 2-НОС6Н4СООН, Тпл = 159 °С, Ткип = 211 °С/20 мм рт.ст., Тсубл = 76 °С. Застосовують у виробництві ЛП (ацетилсаліцилової кислоти, саліциламіду, метилсаліцилату, фенілсаліцилату, оксафенаміду та ін.), як індикатор в аналітичній хімії, антисептик у харчовій промисловості. Галова кислота — 3,4,5-(ОН)3С6Н2СООН, Тпл = 240 °С (з розкладанням), міститься у вигляді естерів у танінах дубової кори, у листі чаю, плодах гранату та ін. Галову кислоту застосовують у синтезі барвників, для одержання пірогалолу, а також як аналітичний реагент. о-Оксикорична кислота 2-НОС6Н4СН=СНСООН існує у вигляді двох геометричних ізомерів: цис-ізомера — кумаринової кислоти, транс-ізомера — кумарової кислоти. Кумаринова кислота, на відміну від кумарової, існує у вигляді похідних. При спробі виділити її у вільному стані перетворюється на лактон — кумарин, поширений у рослинному світі.
Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
