ГІДРАЗОНИ (грец. hydor — вода + франц. azote + грец. а — не + zoos — жива істота) — сполуки, молекули яких містять гідразонний фрагмент 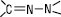 належать до класу азометинів, відрізняються від інших представників (імінів, оксимів та ін.) наявністю двох атомів нітрогену, зв’язаних між собою. Атом нітрогену, що входить в азометинову групу, називається імінним, другий — амінним; загальна формула RR′C=N–NR′′R′′′, де: R, R′, R′′, R′′′ = H, Alk, Ar, Az. При R′′ = R′′′ = H це N,N-незаміщені Г., при R′′ = Alk (Ar, Az), R′′′ = H — алкіл (арил, ацил) Г., а при R′′ = R′′′ або R′′ ≠ R′′′ = Alk (Ar, Az) — діалкіл (діарил, алкіларил, алкілацил тощо) Г. Більшість Г. — тверді речовини. Назви Г. (за номенклатурою IUPAC) утворюють за такими принципами: а) називають замісники біля амінного атома нітрогену, потім додають слово «гідразон», після цього йде назва вихідної карбонільної сполуки, напр.: С6Н5CH = NNHС6Н5 — фенілгідразон бензальдегіду; б) називають замісники біля амінного атома нітрогену, потім йде префікс гідразоно- і назва вуглеводню чи його похідної, якщо є головна група, напр.:
належать до класу азометинів, відрізняються від інших представників (імінів, оксимів та ін.) наявністю двох атомів нітрогену, зв’язаних між собою. Атом нітрогену, що входить в азометинову групу, називається імінним, другий — амінним; загальна формула RR′C=N–NR′′R′′′, де: R, R′, R′′, R′′′ = H, Alk, Ar, Az. При R′′ = R′′′ = H це N,N-незаміщені Г., при R′′ = Alk (Ar, Az), R′′′ = H — алкіл (арил, ацил) Г., а при R′′ = R′′′ або R′′ ≠ R′′′ = Alk (Ar, Az) — діалкіл (діарил, алкіларил, алкілацил тощо) Г. Більшість Г. — тверді речовини. Назви Г. (за номенклатурою IUPAC) утворюють за такими принципами: а) називають замісники біля амінного атома нітрогену, потім додають слово «гідразон», після цього йде назва вихідної карбонільної сполуки, напр.: С6Н5CH = NNHС6Н5 — фенілгідразон бензальдегіду; б) називають замісники біля амінного атома нітрогену, потім йде префікс гідразоно- і назва вуглеводню чи його похідної, якщо є головна група, напр.:
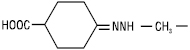
4-метилгідразоноциклогексанкарбонова кислота; в) називають як похідну гідразину, заміщеного двовалентним радикалом R2C=, напр.:
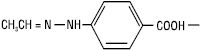
4-етиліденгідразинобензойна кислота. Для Г. характерна просторова (геометрична та оптична) ізомерія. Перша зумовлена sp2-гібридизованим станом імінного атома нітрогену:

Г. — слабкі основи, утворюють солі лише з сильними мінеральними кислотами. Алкілгідразони гідролізуються в кислому середовищі до алкілгідразинів і карбонільних сполук:
Електрофільні реагенти взаємодіють із незаміщеними і монозаміщеними Г. за амінним атомом нітрогену. Під дією аміду калію в рідкому аміаку Г. перетворюються на діаніон, з якого одержують моно- або діалкілгідразони:
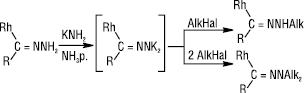
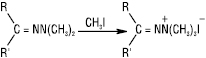
Диметилгідразони при дії галогеналканів, алкілсульфонатів легко перетворюються на солі гідразонію:
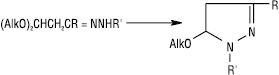
Результатами реакцій внутрішньомолекулярного алкілування моно- і незаміщених Г. є утворення простих і конденсованих гетероциклічних систем, напр.:
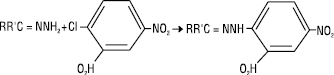
Арилювання Г. активованими галогенаренами проходить дуже легко. Реакцію конденсації Г. з 2,4-динітрохлорбензолом використовують для кількісного визначення Г.:
Внутрішньомолекулярне арилювання зумовлює утворення конденсованих гетероциклів — похідних індазолу:
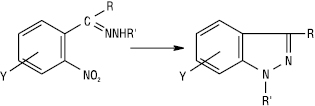
У реакцію ацилювання вступають Г., які містять біля амінного атома нітрогену хоча б один атом гідрогену, при цьому одержують N-ацилгідразони, напр.:

При внутрішньомолекулярному ацилюванні утворюються заміщені піразолони-5:
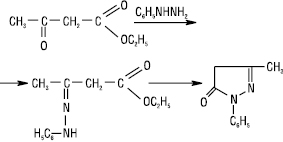
Під дією галогенів у нейтральному середовищі Г. перетворюються на азини, а в лужному відбувається замісникове галогенування:
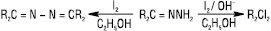
Для арилгідразонів альдегідів галогенування проходить інакше:
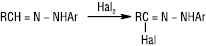
З нуклеофільними реагентами Г. вступають у реакції заміщення біля вуглецевого атома гідразонної групи, напр.:

У деяких випадках реакції SN приводять до утворення гетероциклічних систем:
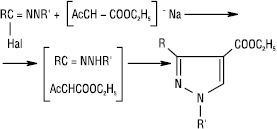
Для Г. характерні реакції приєднання до сполук, що містять кратні зв’язки. Так, незаміщені і монозаміщені Г. карбонільних сполук, а також дизаміщені Г. альдегідів, котрі мають у молекулі рухливий атом гідрогену при атомі карбону або нітрогену гідразонної групи, здатні вступати в реакцію Міхаеля:
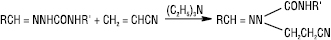
Незаміщені, алкіл-, арил-, гетерил-, ацилгідразони α,β-ненасичених сполук зазнають внутрішньомолекулярної циклоконденсації, яка проходить завдяки нуклеофільному приєднанню N-H фрагмента до кратного зв’язку:
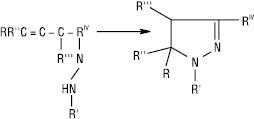
Це приводить до утворення гетероциклів (піразолінів, піразолів, похідних фталазину тощо).
Наявність у молекулах Г. полярного азометинового зв’язку зумовлює можливість перебігу реакцій приєднання за C=N- групою:
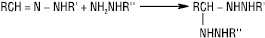
Арилгідразони в кислому середовищі зазнають термічного перегрупування (реакція Фішера), при цьому утворюються похідні індолу:
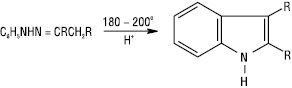
Незаміщені Г. у присутності лугів розкладаються з утворенням вуглеводнів (реакція Кіжнера — Вольфа), що є зручним способом відновлення карбонільних сполук:
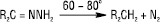
Каталітичним гідруванням Г. кетонів добувають моноалкілгідразини:
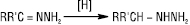
Алкілгідразони при взаємодії з карбонільними сполуками, алкілгідразинами чи гідразонами вступають у реакцію обміну (перегідразонування), напр.:
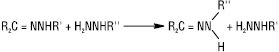
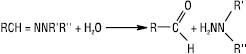
Г. добувають конденсацією гідразину, моно- чи дизаміщених гідразинів з альдегідами або кетонами, напр.:

Незаміщені Г. можуть конденсуватися ще з однією молекулою карбонільної сполуки, перетворюючись на азини. Цю реакцію використовують для синтезу несиметричних азинів:
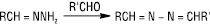
Реакцію гідразинів (головним чином феніл-, 2,4-динітрофенілгідразинів і семікарбазиду) з альдегідами і кетонами використовують для ідентифікації карбонільних сполук. Отримані продукти є кристалічними речовинами, які можна виділити і визначити за Tпл.
Г. застосовують у синтезі лікарських речовин.
Китаев Ю.П., Бузикин Б.И. Гидразоны. — М., 1974; Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 3. Азотсодержащие соединения / Под ред. О.И. Сазерленда. — М., 1982; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
