ОСМОМЕТРІЯ (грец. ôsmos — поштовх, тиск + metreô — виміряю) — сукупність методів визначення осмотичного тиску π. Вимірювання проводять за допомогою приладів — осмометрів різних конструкцій. Розрізняють два основних методи вимірювання осмотичного тиску: статистичний та динамічний.
Статичний метод базується на тому, що осмотичний тиск розчину урівноважується тиском стовпа рідини, який виникає при проникненні розчинника в розчин. Статичний осмометр (рис. 1) містить камеру 1, дном якої є напівпроникна мембрана. Розчин наливають у комірку через верхній отвір 2, куди для вимірювання тиску вставляють градуйований капіляр. Камера з розчином вставляється в посудину 3, заповнену чистим розчинником. Посудина закривається пришліфованою кришкою для того, щоб розчинник не випаровувався.
Динамічний метод ґрунтується на тому, що осмотичний тиск компенсується накладеним на розчин змінним протитиском. Осмотичний тиск розраховується на основі вимірювання швидкості проникнення розчинника крізь мембрану. На рис. 2 представлений компенсаційний осмометр О.В. Думанського. Осмотична комірка 1 з’єднується з мембраною 2, аспіратором 3 і манометром 4. Комірку і зовнішню посудину поміщають у термостат 5. Підійманням верхньої частини аспіратора 6 регулюється зовнішній тиск. При надмірному зовнішньому тиску меніск у капілярі 7 опускається із швидкістю υ1, пропорційною надмірному тиску р1–π. При пониженому зовнішньому тиску меніск підіймається зі швидкістю υ2, пропорційною різниці π–p2. Відношення швидкостей руху розчинника по капіляру υ1/υ2 дорівнює відношенню різниць тисків:
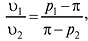
звідки:
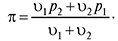
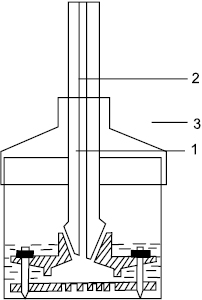
Рис. 1. Статичний осмометр: 1 — камера; 2 — верхній отвір; 3 — посудина
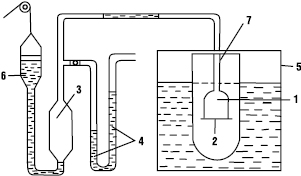
Рис. 2. Динамічний осмометр: 1 — осмотична комірка; 2 — мембрана; 3 — аспіратор; 4 — манометр; 5 — термостат; 6 — верхня частина аспіратора; 7 — капіляр
О. застосовують при розрахунках апаратів зворотного осмосу (див. Осмос) і для визначення мол. м. полімерів. Мол. м. полімерів визначають, як статичними, так і динамічними методами, але статичні простіші й точніші. Експериментально встановлено, що осмотичний тиск розчинів полімерів вищий за осмотичний тиск розчинів низькомолекулярних речовин тих самих концентрацій і описується більш складною залежністю, ніж рівняння Вант-Гоффа (див. Осмос):
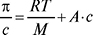 ,
,
де А — константа, що залежить від природи полімеру і розчинника.
Вимірюючи осмотичний тиск ряду розчинів різних концентрацій, розраховують мол. м. полімеру. Для цього будують графік залежності (рис. 3). Екстраполюючи пряму на с=0, визначають величину відрізка B=RT/M, за яким розраховують середню мол. м. полімеру: M=RT/B. За цим методом отримують середньочисельну мол. м., оскільки осмотичний тиск пропорційний числу молекул розчиненої речовини.
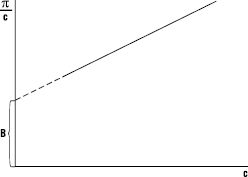
Рис. 3. Залежність 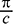 від концентрації розчину полімеру
від концентрації розчину полімеру
Діапазон вимірюваних мол. м. за допомогою О. становить 103–106.
Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін. — Х., 1999; Химическая энциклопедия: В 5 т. — М., 1992. — Т. 3.
