ГІПС (лат. gypsum < грец. gypsos — крейда, вапно) — мінерал кальцію сульфат дигідрат CaSO4·2H2O. Кількісний склад чистого гіпсу — 32,56% CaO, 46,51% SO3 і 20,93% H2O. Г. у природі існує переважно у вигляді суцільних зернистих (алебастр) і волоконних (селеніт) кристалів. Чистий Г. — безбарвний і прозорий, за наявності домішок має сіре, жовтувате, рожеве та інше забарвлення. Г. поширений у природі, найбільші родовища в Україні знаходяться на Донбасі. У природних так званих сульфатних водах (морська, вода солоних озер) міститься CaSO4 у розчиненому вигляді і зумовлює їх постійну жорсткість. Однак розчинність CaSO4 невелика — 202 мг в 100 г H2O, і мало змінюється з підвищенням температури. З водних розчинів при температурі нижче 66 °С кристалізується Г. у вигляді CaSO4·2H2O з утворенням шестигранних моноклінних кристалів густиною 2,32 г/см3. При нагріванні до 150–170 °С природний Г. втрачає 3/4 кристалізаційної води та перетворюється на напівгідрат, який має назву алебастр (безводний CaSO4 називають ангідритом): CaSO4⋅2H2O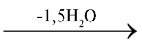 CaSO4⋅0,5H2O. При звичайній температурі алебастр енергійно приєднує воду і при цьому тужавіє: CaSO4⋅0,5H2O
CaSO4⋅0,5H2O. При звичайній температурі алебастр енергійно приєднує воду і при цьому тужавіє: CaSO4⋅0,5H2O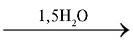 CaSO4⋅2H2O. Перебіг реакції відбувається з виділенням значної кількості теплоти. Час на утворення кристалічної структури CaSO4⋅2H2O становить від кількох хвилин до кількох годин.
CaSO4⋅2H2O. Перебіг реакції відбувається з виділенням значної кількості теплоти. Час на утворення кристалічної структури CaSO4⋅2H2O становить від кількох хвилин до кількох годин.
Якщо замісити алебастр з водою у вигляді рідкого тіста, то він досить швидко тужавіє, утворює тверду масу, що складається з тонковолокнистих, переплетених між собою кристалів Г. Цю властивість Г. використовують у будівництві, а також у медицині для накладення гіпсових пов’язок і шин (див. Гіпсова пов’язка).
Реми Г. Курс неорганической химии. — М., 1972. — Т. 1.
