АРГЕНТОМЕТРІЯ (грец. argis — світлий, білий, блискучий + metria — вимірювання) — титриметричний метод, заснований на реакції осаджування галогенід-іонів, CN–, NCS– та іншими іонами срібла. А. передбачає чотири методи.
Х– + Ag+ → AgХ↓ (Х= Cl–, Br–, I–, CN–, NCS–)
Метод Мора. Пряме титрування галогенід-іонів (Cl–, Br–). Титранти 0,1 М, 0,05 М або 0,01 М розчини AgNO3, індикатор — розчин K2CrO4. Умови титрування — слабкокисле середовище, яке відтворюють за допомогою розведеної НNO3, відсутність іонів Pb2+, Ba2+, Hg22+, Bi3+, PO43–, CO32–, C2O42–, AsO43– та інших, які реагують з K2CrO4 або AgNO3. Кінцеву точку титрування встановлюють за появою червоно-оранжевого осаду, а також за допомогою потенціометричного, кондуктометричного та амперометричного методів. Титрант (розчин AgNO3) стандартизують за стандартними речовинами NaCl, KCl або за стандартними розчинами цих солей. Метод не використовують для визначення I– та NCS–-іонів, тому що при титруванні відбувається співосадження хромату калію з осадами AgI і AgNCS.
Метод Фольгарда (роданометрія, тіоціонатометрія). Зворотне титрування галогенід-іонів, CN–, NCS–, S2–, CO32–, CrO42– та ін. Титранти 0,1 М, 0,05 М або 0,01 М розчини AgNO3 і 0,1 М, 0,05 М, 0,01 М розчини NH4NCS або KNCS. Індикатор — насичений розчин NH4[Fe(SO4)2]. До речовини, що визначають, додають надлишок титрованого розчину AgNO3:
Х– + Ag+ → AgХ↓
Іони срібла, що не прореагували, відтитровують титрованим розчином NH4NCS або KNCS: Ag+ + NCS– 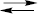 AgNCS↓
AgNCS↓
Кінцеву точку титрування визначають за появою рожевого або червоного (залежно від концентрації [Fe(NCS)3]) забарвлення розчину:
Fe3+ + 3NCS– 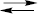 [Fe(NCS)3]
[Fe(NCS)3]
Умови титрування: цей метод дозволяє здійснювати визначення у сильнокислому середовищі. Розчини NH4NCS або KNCS стандартизують за стандартним розчином AgNO3.
Метод Фаянса — Ходакова. Пряме титрування галогенід-іонів. Титрант 0,1 М або 0,05 М розчин AgNO3, індикатор — еозин, флуоресцеїн або інші адсорбційні індикатори (див. Адсорбційні індикатори). Умови титрування: іони, що досліджуються, повинні адсорбувати іони індикатора з більшою силою, ніж молекули осаду; до розчину, що титрують, додають колоїдні розчини крохмалю або декстрину, з метою збільшення площі поверхні осаду; рН середовище, де відбувається визначення, залежить від індикатора, який використовують при титруванні. Напр. визначення з еозином виконують при рН ≈2, а визначення з флуоресцеїном — при рН 7–10. Кінцеву точку титрування встановлюють за різкою зміною забарвлення осаду з білого чи світло-жовтого до рожево-червоного, якщо використовують флуоресцеїн, або рожевого, якщо використовують еозин, а також за допомогою потенціометричного, кондуктометричного та амперометричного методів. Метод використовують для визначення Cl–, Br–, I–, CN–, NCS–-іонів.
Метод Гей-Люссака. Безіндикаторний метод. Титрант 0,1 М або 0,05 М розчин AgNO3. Умови титрування див. Метод Мора. Кінцеву точку титрування визначають візуально за припиненням утворення осаду солі срібла та освітленням розчину. У фармації А. використовують для визначення галогенідів лужних металів, галогенопохідних органічних сполук (після переведення галогенідів у іоногенний стан), речовини, які містять срібло, Ag+— та Hg2+-іони. Можна визначати барбітурати прямим титруванням, які з Ag+ утворюють одно- та двозаміщені солі (останні — не розчинні у воді). Точку кінця титрування визначають за появою каламуті у розчині (моментом утворення двозаміщеної солі барбітурату).
Аналитическая химия (аналитика). В 2 кн. — Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа / Ю.Я. Харитонов. — М., 2001; Основы аналитической химии. В 2 кн. — Кн. 2. Методы химического анализа / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. — М., 2002.
