АЛЬДЕГІДО- і КЕТОКИСЛОТИ (оксокарбонові кислоти, оксокислоти) — органічні сполуки, які містять карбоксильну й альдегідну або кетонну групу. Залежно від взаєморозташування функціональних груп розрізняють α, β-, γ- та інші оксокарбонові кислоти. Для багатьох оксокарбонових кислот широко використовують тривіальні назви. За замісною номенклатурою IUPAC до назви карбонільної групи додають префікс оксо-, напр. НС(О)СООН — гліоксалева (гліоксилова), або оксоетанова; СН3СОСООН — піровиноградна, або 2-оксопропанова кислота. А. і К. сильніші за алканкарбонові кислоти; найсильнішими є α-оксокислоти. Реакційна здатність А. і К. зумовлена наявністю в їх структурі –СООН-груп. За карбоксильною групою вони утворюють різні функціональні похідні — солі, естери, аміди тощо; за участю карбонільної групи вступають у реакції, характерні для альдегідів і кетонів, утворюють гідразони, оксими, ціангідрини та ін. А. легко окиснюються до дикарбонових кислот. Разом з цим А. і К. мають специфічні властивості: α- та β-А. і К. відносно нестійкі сполуки і легко декарбоксилюються, перетворюючись в альдегіди або кетони. На відміну від кислот, естери α-, β-оксокислот — стійкі сполуки, найбільше практичне і теоретичне значення має ацетооцтовий ефір (етиловий естер ацетооцтової кислоти), який використовують у синтезі антипірину, амідопірину, анальгіну та ін.
Можливим і єдиним представником α-А. є гліоксалева кислота (НС(О)СООН) — безбарвна в’язка рідина, легкорозчинна у воді, міститься в нестиглих фруктах. Одержують окисненням етиленгліколю чи гліколевої кислоти азотною (нітратною) кислотою або відновленням щавлевої кислоти на Hg- або Pb-катоді. Легко приєднує воду, утворюючи кристалогідрат НС(ОН)2СООН з Tпл 98 °С. Кислоту застосовують у виробництві ароматичних (ванілін), лікарських речовин та барвників.
Важливим представником α-К. є піровиноградна кислота (СН3СОСООН) — безбарвна рідина з різким запахом, Tпл 13,6 °С, Tкип 165 °С, розчинна у воді, спирті, ефірі. Піровиноградна кислота — проміжний продукт обміну вуглеводів і білків у живих організмах, є одним з метаболітів у циклі трикарбонових кислот, утворюється також при спиртовому та інших видах бродіння вуглеводів. Застосовують у синтезі ЛЗ, напр. цинхофену (атофану).
β-К. — ацетооцтова (β-кетомасляна кислота) є найпростішою β-кислотою. СН3СОСН2СООН — в’язка рідина, Tкип 100 °С (з розкладанням), змішується в усіх співвідношеннях з водою, розчинна в спирті, ефірі. Легко декарбоксилюється при кімнатній температурі або при незначному нагріванні, утворюючи ацетон; міститься в сечі хворих на діабет.
Важливими представниками γ-К. є левулінова та пеніцилова кислоти. Левулінова (γ-кетовалеріанова) кислота (СН3СОСН2СН2СООН) — кристалічна речовина з Tпл 37 °С, Tкип 246 °С, легкорозчинна у воді, спирті, ефірі. При тривалому нагріванні з дегідратаційними засобами утворює суміш двох ненасичених γ-лактонів. Використовується в синтезі лікарських речовин.
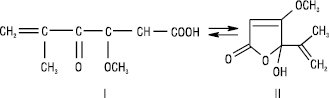
Пеніцилова кислота (І) виявляє властивості антибіотика, у кристалічному стані та у водному розчині знаходиться у формі гідроксилактону (ІІ):
Велике біологічне значення мають також α-К. дикарбонові кислоти. Мезоксалева (кетомалонова) кислота (НООССОСООН) відома тільки у вигляді гідрату НООС-С(ОН)2-СООН (безбарвні кристали з Tпл 121 °С (з розкладанням)), розчинна у воді, спирті, ефірі. Гідрат легко розкладається при нагріванні у водному розчині до СО2 і гліоксалевої кислоти. Виявляє сильні відновні властивості.
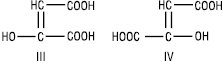
Щавлевооцтова (2-оксобутандіова) кислота (НООССОСН2СООН) є водночас α- та β-оксокислотою, перебуває лише в енольній формі, може бути виділена у формі цисгідроксималеїнової (ІІІ) і трансгідроксифумарової кислот (IV):
Відіграє важливу роль у вуглеводному обміні; є проміжним продуктом у циклі трикарбонових кислот.
α-Кетоглутарова (2-оксопентандіова) кислота (НООССО(СН2)2СООН) — біла кристалічна речовина (Tпл 115–116 °С), розчинна у воді та етанолі. Має важливе значення в біологічних процесах (цикл Кребса), є проміжним продуктом синтезу та розпаду амінокислот.
Неницеску К.Д. Органическая химия. — М., 1963. — Т. 2; Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 4. Карбоновые кислоты и их производные. Соединения фосфора / Под ред. И.О. Сазерленда. — М., 1983; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
