АКТОМІОЗИН (лат. activus — діяльний + грец. myos — м’яз) — складний білок м’язових волокон, що зумовлює їх скорочувальну здатність. А. складається з білків актину та міозину, які утворюють актоміозиновий комплекс, який має АТФазну активність, тобто здатність розщеплювати АТФ, вивільняючи при цьому значну кількість енергії, необхідну для забезпечення скорочувальної діяльності. Скорочувальний апарат м’яза скелета представлений міофібрилами, у яких упаковані протофібрили — товсті та тонкі нитки (філаменти). По всій довжині міофібрили розділені на окремі відсіки (саркомери), довжина яких становить у середньому 2,5 мкм. Вони обмежені Z-мембранами, які служать для кріплення актинових ниток. У центрі саркомера розташовані товсті (міозинові) нитки. Вони утворюють А-диск (анізотропний).
В основі механізму скорочення міофібрили лежить скорочення ниток актину (А) та міозину (М). Етапи: а) вихід Са з ретикулума; б) взаємодія з тропонін-тропоміозином, вивільнення активних точок на нитках актину, формування «містків»; в) зближення ниток актину міозиновими містками (рисунок).
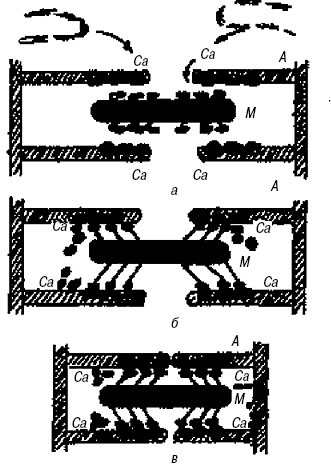
Рис. Механізм скорочення міофібрили
Скріплює товсті нитки М-мембрана, розташована в центрі саркомера. Довжина А-диска — 1,6 мкм. На рівні Z-мембран до кожного саркомера спускаються поперечні трубочки (Т-трубочки), сукупність яких названа Т-системою. Ці трубочки підходять близько (але не впритул, щілина — 10–20 нм) до термінальних цистерн саркоплазматичного ретикулума. Саркоплазматичний ретикулум представлений термінальними цистернами (біля Z-мембран) та поздовжніми трубочками. Саркоплазматичний ретикулум містить іони кальцію в концентрації приблизно 10–2 мМ, чого в принципі досить лише для 5–6 скорочень. На момент генерації потенціалу дії відбувається його поширення вздовж плазматичної мембрани, деполяризація передається на Т-трубочку, що контактує з термінальною цистерною. У результаті відкриваються кальцієві канали, по яких кальцій входить у міжфібрилярний простір міофібрили, що приводить до ініціації скорочення. Потім мембрани поздовжніх трубочок саркоплазматичного ретикулума починають активно відкачувати іони кальцію назад у саркоплазматичний ретикулум, і його концентрація в міжфібрилярному просторі знижується, що приводить до розслаблення. Іони кальцію, що ввійшли у міжфібрилярний простір, ініціюють скорочення. Це відбувається в результаті з’єднання кальцію з однією з 3 субодиниць (кальцієсполучна субодиниця) молекули тропоніну, яка розташовується з інтервалом у 40 нм на актиновій нитці. В умовах спокою ця молекула тропоніну створює умови для того, щоб фібрилярна молекула тропоміозину, яка знаходиться на актиновій нитці, не давала міозиновому містку контактувати з актином (в умовах спокою місток не може з’єднатися з актиновою ниткою, оскільки йому заважає тропоміозин). Коли ж кальцій з’єднується з тропоніном, відбуваються конформаційні зміни в іншій субодиниці тропоніну (інгібуюча субодиниця), у результаті чого нитка тропоміозину просувається в глибину борозенки та звільняє місце на актиновій нитці для зв’язування з міозином. Описана система одержала назву актино-сполучна регуляція. Тропонін та тропоміозин називаються регулювальними білками, тому що вони регулюють стан А. у саркомері. Скорочення відбувається за рахунок ковзання актинових ниток у проміжках між міозиновими. Цей процес здійснюється поперечними містками міозину. Поперечні містки становлять голівки міозину (міозин складається із 2 субодиниць — легкий мероміозин — хвіст міозинової нитки та важкий мероміозин). Важкий мероміозин закінчується субодиницею С-1 — голівкою міозинової молекули. Голівка з’єднана з тілом міозинової нитки за допомогою субфрагмента С-2 (шийки), що може згинатися. Голівка має АТФазну активність, яка проявляється в присутності актину, коли голівка буде безпосередньо прикріплена до актинової нитки. В умовах спокою місток (голівка) не прикріплений до актинової нитки, тому що цьому заважає тропоміозин. На кінчику містка знаходиться молекула АТФ. Коли з’являється кальцій та відходить тропоміозин від актинової нитки, місток під кутом 90° чіпляється до актинової нитки. Відразу відбувається активація АТФазної активності і, як наслідок, гідроліз АТФ із виділенням порції енергії. Ця енергія використовується для проштовхування актинової нитки приблизно на 10 нм (це <1% довжини саркомера). Якщо поруч із містком є вільна молекула АТФ, вона вбудовується на вершину містка та забезпечує відрив містка від актинової нитки. Якщо в середовищі багато кальцію, актинова молекула, як і раніше, вільна від тропоміозину. Тому місток знову прикріплюється до нитки, але вже в іншому місці, а цикл знову повторюється. За період укорочення місток встигає зробити 50 циклів («гребків»), внаслідок чого довжина саркомера зменшується приблизно на 50%. Якщо рівень кальцію знижується (у результаті активності кальцієвого насоса та припинення виходу кальцію з термінальної цистерни), настає процес розслаблення (подовження). У разі, якщо АТФ вичерпана, настає ритор м’яза — немає розчіплювання між актиновою та міозиновою нитками, напр. при трупному задубінні. Скорочувальний білок гладких м’язів ідентичний А. кістякових м’язів (має лише суто кількісну розбіжність). Функціональна активність А. регулюється ЛП. Так, серцеві глікозиди підвищують його скорочувальну здатність в міокарді завдяки посиленню входу іонів кальцію в кардіоміоцити.
Агаджанян Н.А., Тель Л.З., Циркин В.И., Чеснокова С.А. Физиология человека. — М.–Н. Новгород, 2001; Здоровье матери и ребенка / Под ред. акад. Е.М. Лукьяновой. — К., 1993.
