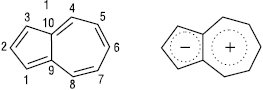
АЗУЛЕНИ (біцикло[5.3.О]декапентаєни) — небензоїдні ароматичні сполуки, які містять конденсовану систему з 5- і 7-членного циклів. Усі атоми карбону 5-членного циклу несуть невеликий негативний заряд; 7-членного (крім атомів карбону, загальних для обох циклів) — позитивний. Унаслідок несиметричності їх циклів А. біполярні (ІІ), вони володіють дипольним моментом. Найпростіший представник А. — азулен (І): сині кристали, Tпл 99 °С, Tкип 170 °С, µ 3,333·10–30 Кл·м. Енергія стабілізації 72 кДж/моль. Гідрується, окиснюється на повітрі і під дією KMnO4 з утворенням CO2, (COOH)2 та ін.
А. з алкільними замінниками забарвлені в інтенсивний синій, фіолетовий, рідше — у зелений колір. У вільному стані — це рідини або кристалічні речовини з Tпл від 40 до 100 °С.
Термін «азулен» запропонував французький хімік Пісс для ефірних олій, забарвлених у темно-блакитний колір, а потім він використовувався для позначення вуглеводню (І) — представника цієї групи сполук.
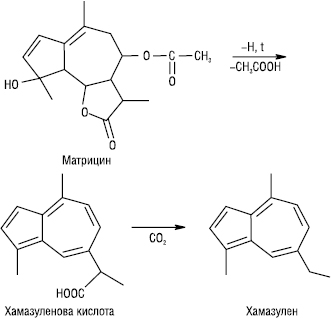
А. у вільному стані в природі виявляють дуже рідко; утворюються дегідруванням S або Se азуленогенів — сесквітерпенових вуглеводнів, спиртів, кетонів, які містяться в ефірних оліях (виявляють їх реакціями Сабетая і Мюллера), а також зі справжніх проазуленів — сесквітерпенових γ-лактонів (гвайазуленів) — під час перегонки ефірної олії з водяною парою. Напр. хамазулен є продуктом перетворення матрицину, що міститься у кошиках хамоміли лікарської. Незважаючи на різноманітність сесквітерпенових сполук, численність А., які утворюються при дегідруванні, незначна.
А. виявлені в ефірних оліях багатьох родин: айстрових, селерових, ясноткових, лаврових, перцевих, геранієвих, валеріанових, аралієвих і деяких інших, приблизно у п’ятій частині досліджених ефірних олій. Азуленогени містяться переважно у квіткових рослинах, але з грибів (Lactarius deliciosus L.) виділено лактаразулен.
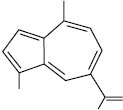
Лактаразулен (1,4-диметил-7-ізопропенілазулен)
Іноді А. утворюються у процесі різних хімічних реакцій. Вони були виділені з буровугільної смоли, при піролізі вуглеводнів, а також з махоркового диму. Відомий випадок виявлення А. у продуктах обміну тваринного походження (у сечі жеребних кобил).
А. в ефірних оліях містяться у мізерній кількості, але їх наявність у незначній кількості (1:10 000) помітна. Уперше виділені А. були названі шляхом додавання частки назви ефірної олії до слова «азулен». Так, речовина, виділена з гваякової смоли, отримала назву гвайазулен, з олії ветиверії — ветивазулен, з олії хамоміли — хамазулен, з евкаліптової — евказулен, з елемолу — елемазулен тощо. Пізніше багато А. було ідентифіковано і виявлено, що евказулен ідентичний s-гвайазулену, елемазулен — ветивазулену тощо.
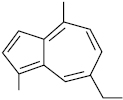
1,4-Диметил-7-етилазулен (хамазулен)
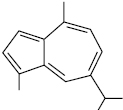
1,4-Диметил-7-ізопропілазулен (s-гвайазулен; гур’юназулен)
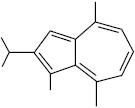
Ветивазулен
А. розчинні у вуглеводнях. При температурі вище 300 °С ізомеризуюються у нафталін і його гомологи. В УФ-спектрах максимуми поглинання лежать в області 550–700 нм. В ІЧ-спектрах характеристичні смуги відзначають при частотах 1570–1577 см-1 (С-С) і 3030–3086 см-1 (С-Н). Унаслідок підвищеної електронної щільності на атомах карбону 5-членного циклу А. виявляють високу активність у реакціях з електрофільними агентами. Вони легко утворюють π-комплекси з електронодефіцитними сполуками, напр. тринітробензолом, тринітротолуолом, пікриновою кислотою, тетраціанхінодиметаном, карбонілами металів. Як сполуки з високою основністю під дією мінеральних або апротонних кислот А. утворюють солі, напр.:
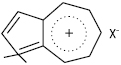
Здатність розчинятися у 60% H2SO4 або 85% H3PO4 з утворенням солей використовується для виділення А., оскільки сіль гідролізується при розведенні кислотного розчину водою. Біполярна будова пояснює більшу легкість електрофільного заміщення в А., ніж в ароматичних сполуках, причому перший замісник вступає у положення 1, другий — у 3. У цих реакціях (напр. нітрування, галогенування, ацилювання, азосполучення) А. за реакційною здатністю аналогічні високоактивним 5-членним гетероциклам. Радикальне заміщення при взаємодії А. з нітроацетанілідом або діазосполуками відбувається також у положенні 1 або 3. Нуклеофільні реагенти (напр. RLi, RMgX) вступають у положення 4, 6 або 8.
У промисловості А. отримують дегідруванням у присутності окиснювачів (S або Se) сесквітерпенів, виділених з ефірних олій, напр. гвайазулен синтезовано дегідратацією гвайолу, виділеного із смоли деревини гваяка, з наступним дегідруванням.
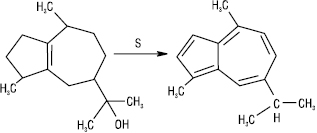
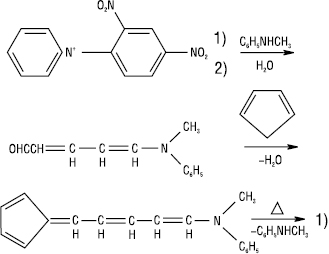
Найзручніший синтез із солей піридинію або пірилію і циклопентадієну або їх гомологів, напр.:
А. мають протизапальну, бактеріостатичну, антиалергічну активність і виявляють седативну дію. На їх основі виготовляють ЛП для лікування гастритів, колітів, виразок дванадцятипалої кишки, гастропатії, синуситів, циститів і стоматитів. А. перевіряли на антиканцерогенність, але результати виявилися негативними. За кордоном А. широко використовують з профілактичною метою, а також для лікування променевих, рентгенівських дерматитів та інших захворювань. Завдяки протизапальним властивостям А. застосовують для виготовлення кремів, мазей, які захищають шкіру від сонячних опіків, для губних помад, зубних паст, води для полоскання рота і миття волосся.
Горяев М.И., Плива И. Методы исследования эфирных масел. — Алма-Ата, 1962; Де Майо П. Терпеноиды. — М., 1963; Хельброннер Е. Небензоидные ароматические соединения. — М., 1963; Химическая энциклопедия. В 5 т. / Редкол. И.Л. Кнунянц и др. — М., 1988. — Т. 1.
