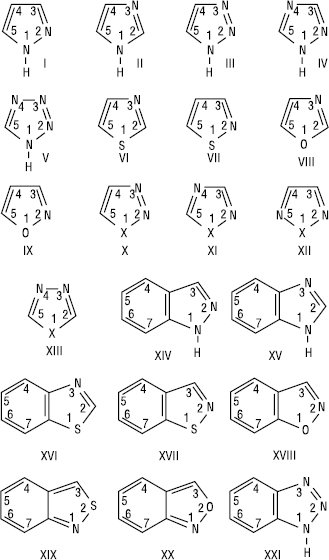
Азоли — п’ятичленні гетероароматичні сполуки, які містять у циклі не менше 2 гетероатомів, один з яких — атом нітрогену, а також бі- і поліциклічні конденсовані системи на основі азольного циклу. До цієї групи сполук відносять моноциклічні системи та їх бензопохідні: діазоли — піразол (І), імідазол (ІІ); триазоли — 1,2,3-, 1,2,4-триазоли (ІІІ, ІV), тетразол (V), тіазол (VI), ізотіазол (VII), оксазол (VIII), ізоксазол (ІХ), окса- і тіадіазоли (1,2,3-, 1,2,4-, 1,2,5-, 1,3,4-оксадіазоли і тіадіазоли, Х=О, S, Х-ХІІІ), індазол (бензопіразол) (XIV), бензимідазол (XV), бензотіазол (XVI), 1,2-бензізотіазол (XVII), 1,2-бензізоксазол (XVIII), 2,1-бензізотіазол (XIX), 2,1-бензізоксазол (ХХ), бензотриазол (ХХІ):
Для А. застосовують номенклатуру, яка об’єднує тривіальні і систематичні назви (Ганча — Відмана), однак, практично всі назви азотвмісних сполук мають закінчення «-азол». У молекулах діазолів, триазолів і тетразолів присутні 2 типи атомів нітрогену в sp2-гібридизації: один — з парою електронів на р-АО ортогональній площині молекули (кислотний центр), а другий — з парою електронів на sp2-АO у площині циклу (основний, нуклеофільний центр). Імідазол — основа середньої сили, інші А. — слабкі основи; сила основи зменшується зі збільшенням кількості атомів нітрогену в молекулі (-I-ефект). Кисневмісні А. менш основні, особливо якщо гетероатом міститься поряд із центром протонування.
Кислотність азолів зростає зі збільшенням кількості атомів нітрогену: триазоли за кислотністю можна порівняти з фенолом, а 1Н-тетразол — з ацетатною кислотою. N-Незаміщені А. легко утворюють водневі зв’язки в рідинних та твердих фазах. Формування водневих зв’язків менш вірогідне в ряду N-заміщених А., оксазолів і триазолів. Для N-незаміщених ди-, три- і тетразолів характерна прототропна таутомерія. Завдяки швидкому протонному переносу 3- і 5-заміщені піразоли або 4- і 5-заміщені імідазоли взаємоперетворюються настільки швидко, що їх неможливо розділити.
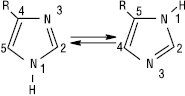
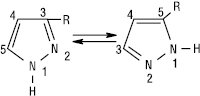
Таутомери також можуть існувати в розчині переважно в одній із форм. Азоли стійкі до дії кислот і окисників. По відношенню до електрофільних агентів Азоли менш активні, ніж їх п’ятичленні аналоги з одним гетероатомом. Імідазол — амфотерна сполука. Катіон імідазолію та імідазоліл-аніон — симетричні делокалізовані структури. Електрофільне заміщення в сильнокислому середовищі інгібується протонуванням атома нітрогену, перебігає переважно за положенням 4. Нуклеофільне заміщення орієнтоване за положенням 2. У піразолі реакції SE проходять за положенням 4. Для три- і тетразолів електрофільне заміщення за атомом карбону не притаманне. Нуклеофільне заміщення порівняно з діазолами перебігає досить легко. Три-, тетразоли, які містять угруповання –N=N–, можуть при нагріванні або під дією світла розщеплюватися з втратою азоту. Оксазоли проявляють слабкий ароматичний характер і вступають у реакції приєднання і циклоприєднання. В оксазолах, тіазолах та їх бензоаналогах нуклеофільне заміщення перебігає за положенням 2. В ізоксазолах розкриття циклу відбувається за слабким зв’язком N–O, що використовують у синтетичних цілях. У деяких оксадіазолах, тіадіазолах нуклеофільне заміщення перебігає швидко за положенням, активованим атомами нітрогену.
Імідазол входить до складу амінокислоти гістидину та продукту її декарбоксилування — гістаміну. Гістидинові залишки виявлені в активних положеннях рибонуклеази та деяких інших ферментах. Похідні І. широко застосовують у фармації: 2-нітроімідазол (азоміцин) — природний антибіотик, метронідазол — антимікробний препарат, біфоназол, клотримазол — антимікотичні препарати. Імідазольний цикл містять деякі циклічні уреїди (парабанова кислота, гідантоїн). Піразол і його похідні входять до складу ЛП амінофеназону амідопірину, метамізолу натрію, фенілбутазону, які виявляють протизапальну, анальгезивну та жарознижувальну дію. Тетразоли відіграють важливе значення в медичній хімії, оскільки N-незаміщені тетразоли можна розглядати як аналоги карбонових кислот. Були синтезовані аналоги амінокислот та інших природних карбонових кислот, у молекулах яких карбоксильна група заміщена тетразольним циклом. Бензимідазол міститься у складі структури вітаміну В12, деяких фунгіцидів, противиразкових препаратів (зокрема омепразолу) та ін. Похідні тіазолу, на відміну від оксазолу, широко розповсюджені у природі: вітамін В1 (тіамін), блеоміцинові антибіотики, які виявляють протипухлинну активність. Деякі напівсинтетичні β-лактами (цефотаксим) містять фрагменти 2-амінотіазолу в боковому ланцюгу. Існує декілька природних ізоксазолів, які виявляють цінні фармакологічні властивості. Мусцимол, виділений з мухомора, виявляє сильну психотропну дію, впливає на нервові клітини мозку, які використовують γ-аміномасляну кислоту як нейротрансмітер. Структура цієї сполуки була взята за основу при створенні низки синтетичних ізоксазолів як потенційних анальгетичних речовин. Циклосерин та ізоксазолін — протитуберкульозні і протипухлинні природні антибіотики. Деякі напівсинтетичні пеніциліни (оксацилін, клоксацилін, доклоксацилін) містять ізоксазольний фрагмент у бокових ланцюгах. Похідні А. також застосовують у промисловому синтезі ЛП, пестицидів, барвників, оптичних вибілювачів тощо.
Азотсодержащие гетероциклы / Под ред. П.Г. Сэммса. — М., 1985; Джилкрист Т. Химия гетероциклических соединений. — М., 1996; Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 8; Черних В.П., Зіменковський Б.С., Гриценко І.С. Органічна хімія / За заг. ред. В.П. Черних. — Х., 2008.
