ДОБУТОК РОЗЧИННОСТІ (ДР, КS) — добуток рівноважних концентрацій іонів у насиченому розчині малорозчинного сильного електроліту. Показники ступеня для концентрацій, які входять у ДР, дорівнюють стехіометричним коефіцієнтам у рівнянні дисоціації електроліту. Для кожного електроліту при певній температурі і в певному розчиннику ДР є сталою величиною. Сталість ДР виводять із закону діючих мас згідно з рівновагою тверда фаза 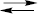 її насичений розчин. При цьому припускають, що у розчині електроліт знаходиться тільки у вигляді іонів. У загальному вигляді вираз ДР для малорозчинної речовин Кх Ау, що розпадається на іони за рівнянням Кх Ау
її насичений розчин. При цьому припускають, що у розчині електроліт знаходиться тільки у вигляді іонів. У загальному вигляді вираз ДР для малорозчинної речовин Кх Ау, що розпадається на іони за рівнянням Кх Ау 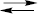 х Ку+ + у Ах–, має вигляд ДР Кх Ау = [ Ку+] х ⋅ [А х–] у.
х Ку+ + у Ах–, має вигляд ДР Кх Ау = [ Ку+] х ⋅ [А х–] у.
Значення ДР малорозчинних у воді сполук визначають за допомогою електрохімічних методів: шляхом вимірювання електрорушійної сили або за електропровідністю насичених розчинів. У таблицях значення ДР наводять при температурах 18–25 °С. З ДР визначають умови утворення і розчинення осаду. Якщо добуток рівноважних концентрацій іонів у насиченому розчині дорівнює ДР малорозчинного електроліту, то гетерогенна система знаходиться у стані рівноваги: AgCl 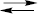 Ag+ + Cl–, ДРAgCl = [Ag+ ]⋅[Cl–]. Малорозчинний електроліт випадає в осад, коли добуток рівноважних концентрацій іонів більший за значення ДР: [ Ag+ ]⋅[ Cl–] > ДРAgCl.
Ag+ + Cl–, ДРAgCl = [Ag+ ]⋅[Cl–]. Малорозчинний електроліт випадає в осад, коли добуток рівноважних концентрацій іонів більший за значення ДР: [ Ag+ ]⋅[ Cl–] > ДРAgCl.
Оскільки ДР при певній температурі є сталою величиною, то підвищення концентрації одного з іонів, на які дисоціює сполука, призводить до зниження концентрації іншого. Якщо до насиченого розчину AgCl додати розчин сполуки, яка містить іон Ag+ або Cl–, то рівновага AgCl 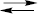 Ag+ + Cl– порушується і згідно з принципом Лє Шательє зміщується ліворуч, тобто з розчину почне випадати AgCl.
Ag+ + Cl– порушується і згідно з принципом Лє Шательє зміщується ліворуч, тобто з розчину почне випадати AgCl.
У свою чергу, осад розчиняється, коли один з його іонів утворює малорозчинну сполуку, слабкий електроліт, комплексний іон або бере участь у реакції окиснення-відновлення. Якщо до гетерогенної системи, яка складається з осаду AgCl і насиченого розчину його іонів, додати концентрований розчин NH3, то внаслідок комплексоутворення Ag+ + 2NH3  [Ag (NH3)2]+ знижується концентрація катіонів Ag+ у розчині, що спричиняє додаткове розчинення осаду. Це має велике практичне значення в процесах осаджування, розчинення, висолювання в аналітичній хімії та хімічній технології.
[Ag (NH3)2]+ знижується концентрація катіонів Ag+ у розчині, що спричиняє додаткове розчинення осаду. Це має велике практичне значення в процесах осаджування, розчинення, висолювання в аналітичній хімії та хімічній технології.
Крешков А.П. Основы аналитической химии. — М., 1965. — Т. 1; Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. — Х., 2000.
