ЕТИЛЕНОВІ ВУГЛЕВОДНІ, алкени, олефіни (франц. gas olefant — олієутворювальний газ) — вуглеводні аліфатичного ряду, які містять один подвійний зв’язок. Загальна формула Е.в. СnH2n. Вони становлять гомологічний ряд, першим представником якого є етилен СН2=СН2. Назви Е.в. за замісниковою номенклатурою IUPAC утворюють шляхом заміщення суфікса -ан у назві відповідного насиченого вуглеводню на -ен; положення подвійного зв’язку позначають цифрою, при цьому нумерація починається з того кінця ланцюга, до якого ближче розташований подвійний зв’язок: СН3-СН=СН–СН2–СН(СН3)–СН3 — 5-метилгексен-2. Для перших членів гомологічного ряду більш уживаними є тривіальні назви — етилен, пропілен, бутилен тощо, причому назві першого представника «етилен», за правилами IUPAC, надається перевага перед назвою «етен». Інколи використовують раціональну номенклатуру, за якою вуглеводень розглядають як похідну етилену, в якому атоми гідрогену заміщені на радикали: СН3–СН=СН2 — метилетилен. Для Е.в., починаючи з С4Н8, характерна структурна ізомерія (ізомерія вуглецевого скелета, ізомерія положення подвійного зв’язку), а також геометрична (цис-, транс-) ізомерія, що зумовлено значним бар’єром обертання навколо подвійного зв’язку. За нормальних умов перші чотири представники алкенів — гази, сполуки С5-С17 — безбарвні рідини, далі йдуть тверді речовини. Е.в. практично нерозчинні у воді, обмежено розчинні у спиртах і добре — у вуглеводнях, їх галогенопохідних, етерах, естерах. Реакційну здатність Е.в. визначає наявність в їх молекулі подвійного С=С зв’язку. Атоми карбону, поєднані подвійним зв’язком, знаходяться в sp2-гібридизованому стані й утворюють δ- і π-зв’язки, з яких π-зв’язок менш міцний. Він складається з двох базисних орбіталей — зв’язувальної і розпушувальної, утворених за рахунок π-орбіталей атомів С. Енергія зв’язку — ~ 615 кДж/моль, довжина — 0,134 нм, для етилену валентні кути дорівнюють 120°. Внаслідок високої поляризованості та низької енергії утворення π-зв’язку алкени досить легко вступають у реакції електрофільного приєднання за подвійним зв’язком. Е.в. взаємодіють з галогенами з утворенням віцинальних дигалогенопохідних; умови перебігу реакції залежать від природи галогену (реакцію з F2 проводять при температурі –78 °С, константа рівноваги реакції йодування дуже мала). Відомі методи заміщення атомів гідрогену галогеном зі збереженням подвійного зв’язку. Так, при взаємодії олефінів з N-бромсукцинімідом у CCl4 у присутності пероксидів (реакція Воля — Циглера) або солями хлорнуватистої кислоти утворюються α-галогенопохідні:
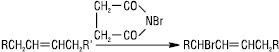
Пряме галогенування Е.в. при температурі 400–600 °С також призводить до заміщення атомів Н, напр. хлоруванням пропілену одержують хлористий аліл CH2ClCH=CH2, який є вихідним продуктом у синтезі синтетичного гліцерину. Ці реакції здійснюються за радикальним механізмом. Подібно до галогенів приєднуються до Е.в з утворенням галогеногідринів і гіпогалогенної кислоти (HOCl, HOBr, HOI). Гідратація Е.в. можлива лише у присутності кислотних каталізаторів, напр. H2SO4, H3PO4, HClO4 та ін. Таким чином, у промисловості з етилену і пропілену одержують етиловий та ізопропіловий спирти. Реакцію гідратації можна здійснити і в газовій фазі — при підвищенні температури і тиску, Kt — Al2O3, ZnCl2 тощо. У присутності кобальтових каталізаторів Е.в. реагують з СО і Н2 з утворенням, залежно від умов, альдегідів чи спиртів (так званий оксосинтез). Приєднання Н2 до Е.в. на гетерогенних каталізаторах (металічні дрібнодисперсні Ni, Pt, Pd), гомогенне каталітичне гідрування (Kt — [(C6H5)3P]3RhCl або [(C6H5)3P]3RuClH), відновлення за допомогою дііміду приводять до утворення відповідних алканів. Е.в. вступають у реакцію гідроборування. Триалкілбор можна легко окиснити в лужному середовищі до відповідного спирту:
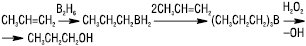
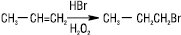
У полярних середовищах Е.в. реагують з галогеноводнями з утворенням алкілгалогенідів, приєднання електрофілів відбувається за правилом Марковникова. У реакції з НBr або амінами порядок приєднання залежить від наявності чи відсутності домішок пероксидних сполук, оскільки в їх присутності відмічається протилежний до правила Марковникова ефект:
Алкени вступають у реакції АЕ зі спиртами, кислотами, галогенангідридами й ангідридами карбонових кислот (реакція Дарзана):
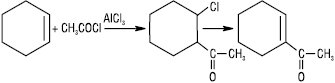
Приєднуються до солей перехідних і платинових металів (Ag+, Ru+, Hg2+, Pb4+, Cu2+), утворюючи при цьому р-комплекси, напр. FeCl2·C2H4·H2O реагують з N2O3, N2O4, NOCl, IN3 з утворенням, як правило, кристалічних адуктів. Е.в. проявляють високу алкілувальну здатність — у присутності кислот Льюїса (AlCl3, BF3, HF та ін.) вони реагують з насиченими вуглеводнями. Розгалужені алкани, які утворюються при цьому, застосовують як високооктанові домішки до моторного палива. В умовах реакції Фріделя — Крафтса бензен алкілується етиленом до етилбензену (напівпродукту у синтезі стирену), пропіленом — до кумену (ізопропілбензену), який використовують для одержання ацетону і фенолу. При підвищеній температурі у присутності каталізаторів (кислоти, ZnCl2 тощо) Е.в. схильні до ізомеризації: при цьому відбувається міграція подвійного зв’язку α-олефінів у β-положення, а також можлива ізомеризація вуглецевого скелета. Велике практичне значення мають процеси полімеризації Е.в. Кислотні каталізатори викликають катіонну полімеризацію алкенів. Етилен за цих умов полімеризується досить важко, пропілен та ізобутилен у безводних середовищах утворюють полімери з дуже довгими ланцюгами. У присутності 60% H2SO4 ізобутилен димеризується, гідрування димеру приводить до утворення ізооктану. У присутності вільних радикалів Е.в. полімеризуються за ланцюговим механізмом. Вільнорадикальна полімеризація етилену у промисловості проводиться під тиском 100 МПа та вище і за температури 100 °С, процес ініціюється пероксидами або О2 (сліди). Пропілен та ізобутилен за радикальним механізмом полімеризуються погано. Реакції нуклеофільного приєднання для Е.в. менш характерні і перебіг їх можливий лише за умов взаємодії з сильними нуклеофілами, напр. з металоорганічними сполуками типу С4Н9Li. До реакцій AN належать аніонна полімеризація Е.в. (із застосуванням каталізатора Циглера — Натті). У промисловості так одержують високомолекулярний поліетилен, стереорегулярний ізотактичний поліпропілен, етилен — пропіленовий каучук. Реакційноздатні карбени приєднуються до подвійного зв’язку з утворенням циклопропанового фрагмента — циклопропанування:
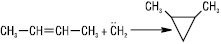
Відомі реакції 1,3-диполярного циклоприєднання та дієновий синтез. Е.в. легко окиснюються і залежно від умов реакції окиснення утворюються різні речовини. Напр., при дії KMnO4 (у кислому середовищі) — суміш карбонових кислот і кетонів, при дії KMnO4 (слабколужний розчин) — гліколі (реакція Вагнера), так само діє OsO4 в органічних розчинниках; HIO4 у присутності OsO4 розщеплює молекули Е.в. за подвійним зв’язком з утворенням суміші карбонільних сполук. Те ж відбувається при озонолізі й розкладанні озонідів. Реакцію Вагнера та озонування використовують для визначення будови Е.в. Дія молекулярного кисню на Е.в. у газовій фазі (150–300 °С) у присутності каталізатора (Ag) приводить до утворення епоксисполук. Таким чином у промисловості синтезують етилен- і пропіленоксиди. Епоксиди утворюються кількісно при дії на Е.в. надкислот або Н2О2 в ацетонітрилі:
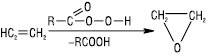
При окисненні етилену і пропілену киснем повітря (CuCl2 і PdCl2) одержують відповідно ацетальдегід і ацетон. Відомі також методи окиснення Е.в., при яких не залучаються подвійні зв’язки; напр. у промисловості газофазним окисненням пропілену одержують акролеїн, внаслідок окиснювального амонолізу утворюється акрилонітрил.
Основним способом добування Е.в. є використання нафтопродуктів і природного газу. З газів рідкофазного та парофазного крекінгу комбінацією методів роздрібної адсорбції, глибокого охолодження і ректифікації під тиском можна виділити індивідуальні Е.в. У лабораторних умовах та у невеликій кількості у промисловості Е.в. одержують дегідратацією спиртів над Al2O3 або ThO2 при температурі 400–420 °С або за допомогою кислотних дегідратних агентів (H2SO4, ZnCl2, P2O5 і ін.). Метод зручний у разі одержання нижчих олефінів, тому що у випадку більш складних Е.в. реакція часто супроводжується ізомеризацією. Е.в. (головним чином цис-ізомери) із заданим положенням подвійного зв’язку можна одержати піролізом естерів карбонових кислот:
CnH2n+1COOCH3 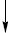 CnH2n + CH3COOH
CnH2n + CH3COOH
або з естерів ксантогенової кислоти за методом Чугаєва:
CnH2n+1OCSSCH3 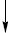 CnH2n + COS + CH3SH.
CnH2n + COS + CH3SH.
Подвійний зв’язок може бути одержаний дегідрогалогенуванням галогенопохідних вуглеводнів спиртовим розчином лугу; дегалогенуванням віцинальних дигалогеналканів дією Zn, NaI у CH3OH, солями Cr(II) або Na2S2O3 в ДМСОі; розкладанням четвертинних амонієвих основ (реакція Гофмана); гідруванням ацетиленових вуглеводнів або дегідруванням алканів; дією алкіліденфосфоренів на карбонільні сполуки (реакція Віттіга), відновлювальним поєднанням альдегідів і кетонів при обробці LiAlH4 та ін.
Е.в. — основні вихідні реагенти у хімічній промисловості. З етилену і пропілену одержують різноманітні полімери та еластомери, епоксисполуки, дихлоретан, етанол, стирен та ін. Поліетилен по-різному використовується у фармації, по-перше, для виготовлення пакувальних виробів (флаконів, шприців, крапельниць, корків та ін.); по-друге, як скелетоутворювальний матеріал для матриці у виробництві таблеток. Поліетилен високого тиснення з вазеліновим маслом є мазевою основою («Plastibas»). Композиції поліетилену з вазеліновим маслом або поліпропілену з мінеральним маслом у певних концентраціях («Plastibasе», «Selene», «Plastonite», «Sguile») придатні для приготування мазей з іхтіолом, дьогтем, перуанським бальзамом та ін. Ізобутилен — сировина для одержання бутилкаучуку, ізопрену, трет-бутилового спирту; його використовують для алкілування фенолів при синтезі ПАР. α-Олефіни складу С10-С18 задіяні у синтезі ПАР, а також в одержанні вищих спиртів.
Молекули з подвійним зв’язком дуже поширені у природі і відіграють важливу біологічну роль. Напр. до складу рослинних жирів входять ненасичені та поліненасичені кислоти, багато рослин містять олієподібні суміші речовин, відомі як терпени; в організмі тварин міститься вітамін А (ретинол), деякі алкени мають властивості, характерні для феромонів. Так, один із вищих гомологів етилену цис-9-трикозен (мускалур) СН3(СН2)12СН = СН(СН2)7СН3 є статевим атроктантом самки домашньої мухи. Найпростіший алкен етилен — гормон росту рослин, який контролює достигання фруктів і появу у них забарвлення. При дії на організм він викликає загальний наркоз. Введення подвійного зв’язку в молекули може посилити або суттєво змінити фізіологічну дію речовини. Трихлоретилен (Cl2C=CHCl) має значно більшу наркотичну дію порівняно з хлороформом чи етилхлоридом, а при введенні в морфін алільної групи замість метильної одержують його антагоніст.
Жогло Ф., Возняк В., Попович В., Богдан Я. Допоміжні речовини та їх застосування в технології лікарських форм. — Львів, 1996; Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 1. Стереохимия, углеводороды, галогеносодержащие соединения. — М., 1981; Терней А. Современная органическая химия. В 2 т. — М., 1981; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
