ЕТИЛАЦЕТАТ, Ethylis acetas (PhEur), Ethyl acetate (BP, USPNF), Ethyl acetate (CAS № 141–78–6); син.: аcetic acid ethyl ester, acetic ester, acetic ether, acetoxyethane, aethylis acetas, aethylium aceticum, ethyl ethanoate, vinegar naphtha. Прозора, безбарвна, летка рідина з приємним фруктовим та трохи оцтовим запахом, має приємний смак при розведенні.
C4H8O2 Мол. м. 88,1
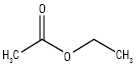
Е. одержують повільною дистиляцією суміші етилового спирту й оцтової кислоти за наявності концентрованої сульфатної кислоти, а також з етилену при використанні каталізатора (алкоголяту алюмінію). Е. має такі властивості: Tсамозайм — 486,1 oС; Tкип — 77 oС; діелектрична постійна — 6,11; густина — 0,902 г/cм3 при 20 °C; концентраційні межі вибуху пари у повітрі — 2,2–11,5% (за об’ємом); Tзайм +7,2 oС (у відкритій чашці), –5,0 °C (у закритій чашці); tзамерз –83,6 °C; коефіцієнт розподілу Log P (октанол/вода) = 0,7; густина пари — 3,04 (повітря = 1); розчинний у воді (1 : 10) при 25 oС, більш розчинний у воді при низьких температурах, ніж при високих; змішується з ацетоном, хлороформом, дихлорметаном, етиловим спиртом (95%), етером та з більшістю інших органічних розчинників.
Відомі такі азеотропні суміші: Е. (93,9%) — вода (6,1%), Tкип — 70,4 °C; Е. (83,2%) — вода (7,8%) — етиловий спирт (9,0%), Tкип — 70,3 °C; Е. (69,4%) — етиловий спирт (30,6%), Tкип — 71,8 °C; Е. (77%) — пропан-2-oл (23%), Ткип — 74,8 °С.
Е. повільно розщеплюється при вологості й стає кислим; може абсорбувати до 3,3% води (за масою). Е. розпадається при нагріванні, перетворюючись на етиловий спирт і оцтову кислоту, з виділенням їдкого диму та подразливої пари. Він вогненебезпечний, пари можуть переміщуватися на значну відстань і стати джерелом займання, можуть викликати «спалах полум’я». Лужний гідроліз Е. може вповільнюватися поліетиленгліколем і змішаними міцельними системами. Е. може вступати в реакцію із сильними окисниками, сильними лугами, сильними кислотами й нітратами, викликаючи вогонь або спалахи, із хлоросульфоновою кислотою, літію-алюмініюгідридом, 2-хлорометилфураном.
Е. зберігається в герметично закритій тарі у захищеному від світла місці при температурі, що не перевищує 30 °C.
У фармацевтичному виробництві Е. використовується як розчинник, а також як смакова добавка, зокрема як розчинник у виробництві розчинів і гелів, для підвищення розчинності хлорталідону та зміни поліморфних кристалічних форм, отриманих для піроксикаму півалату й мефенаменової кислоти, а також як желатинуюча речовина у виробництві вибухових речовин. Використовується також при одержанні мікросфер; був досліджений як хімічний підсилювач для трансдермального іонофорезу інсуліну. Е. використовують як розчинник для нітроцелюлози, целулоїду, алкідних, алілових, вінілових, полівінілацетатних смол, хлоркаучуку та ін.; у суміші зі спиртом — для розчинення ацетилцелюлози і лаків. Для потреб харчової промисловості Е. головним чином використовується як смакова добавка, як компонент фруктових есенцій та екстрагент у харчовій промисловості; як віддушка в композиціях з фруктовим запахом, у вигляді слідів у композиціях «Цикламен», «Яблуко», «Малина», «Суниця», «Хміль», «Слива», «Груша», «Банан» та ін. У милах нестійкий.
Е. виявляє наркотичну дію, його пари подразнюють слизові оболонки очей та дихальних шляхів, при дії на шкіру може викликати дерматити та екземи. ГДК у повітрі робочої зони — 200 мг/м3.
Фридман Р.А. Парфюмерия. — М., 1955; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007; Giordano F., Gazzaniga A., Moyano J.R. et al. Crystal forms ot piroxicam pivalate: preparation and characterization of two polymorphs // J. Pharm. Sci. — 1998. — № 87 (3); Pillai O., Nair V., Panchagnula R. Transdermal iontophoresis of insulin: IV. Influence of chemical enhancers // Int. J. Pharm. — 2004. — № 269 (1); Romero S., Escalera B., Bustamante P. Solubility behavior of polymorphs I and II of mefenamic acid in solvent mixtures // Int. J. Pharm. — 1999. — № 178.
