Естери (складні ефіри) — це функціональні похідні карбонових або мінеральних кислот, в яких гідроксильна група заміщена залишком спирту або фенолу (OR). Напр. R–ONO2; RCOOR’, де R,R’ — алкіл, арил, гетерил. Для багатоосновних кислот розрізняють повні (середні) і неповні (кислі) Е., напр. ROSO2OR’ і ROSO2OH, ROCOCH2COOR’ і ROCOCH2COOH відповідно.
Будову Е. карбонових кислот можна представити двома резонансними структурами:
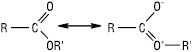
Ефірна група планарна або близька до неї, в різних Е. довжина зв’язку С=О ~ 0,131–0,136 нм, валентний кут 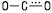 122–126о,
122–126о, 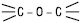 — 113–118°.
— 113–118°.
За замісною номенклатурою IUPAC назви Е. утворюють від назв алкільної або арильної групи гідроксильної складової та назви кислоти шляхом заміни закінчення -ова і слова «кислота» на суфікс -(о)ат, напр. НСООСН3 — метилметаноат, С2Н5ОSO2OH — етилсульфат, НОOС(СН2)2СООСН3 — монометилсукцинат. Е. також називають за спиртовим радикалом і кислотою, додаючи слово «естер»: метиловий естер оцтової кислоти. Загальновживані і такі назви: алкілформіат, алкілацетат (етилацетат) та ін. Деякі Е. мають специфічні назви (напр. уретани). Е. нижчих карбонових кислот і низькомолекулярних спиртів — безбарвні леткі рідини, найчастіше з приємним запахом. Е. вищих карбонових кислот — тверді безбарвні речовини, практично без запаху. Нижчі Е. мінеральних кислот (алкілсульфіти, алкілсульфати, алкокси- й арилоксиборати) — маслянисті рідини з приємним запахом, а починаючи з н-нонілсульфату — тверді сполуки. Деякі Е. існують у вигляді полімерних форм (метафосфатів). Е., як правило, малорозчиняються у воді, легко розчиняються у більшості органічних розчинників. Ткип. нижчих Е. зазвичай нижча за Tкип. відповідних карбонових кислот, які входять до їх складу, що пов’язано з відсутністю міжмолекулярних водневих зв’язків. Ткип. сульфітів нижча, ніж у відповідних сульфатів. Е. відносно стабільні щодо нагрівання. Е. проявляють електрофільний характер, проте він менш виражений порівняно з галогенангідридами та ангідридами карбонових кислот. Е. реагують з нуклеофільними реагентами, утворюючи відповідну карбонову кислоту або різноманітні функціональні похідні цієї кислоти:
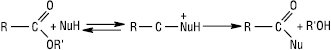
Найбільш відомі реакції з водою (гідроліз), спиртом (алкоголіз або переетерифікація), амоніаком, амінами (аміноліз), гідразинами (гідразиноліз). Е. гідролізуються як у кислому (мінеральні кислоти), так і в лужному (водні або спиртові розчини NaOH, KOH, Ba(OH)2) середовищі. Лужний гідроліз називають також омиленням:
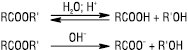
Кислотний гідроліз є зворотним процесом, лужний — практично незворотним. Е. гідролізуються також під дією ферментів — гідролаз, напр. ацетилхолін — ацетилхолінестерази (АХЕ):
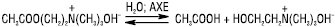
Взаємодія з алкоксидами у розчині відповідного спирту або зі спиртами у присутності кислотного каталізатора (H2SO4, HCl сухий) зумовлює обмін алкільних груп Е. (переетерифікація або алкоголіз):

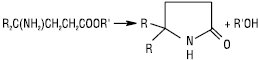
При взаємодії Е. з амоніаком і амінами одержують відповідно аміди RCONH2 і N-заміщені аміди RCONHR’, RCONR’R» (Kt — NH4Cl або CH3OK). Особливо легко відбувається внутрішньомолекулярний аміноліз, напр. аміноестери циклізуються при кімнатній температурі, утворюючи піролідони:
З NH2OH Е. утворюють гідроксамові кислоти RCONHOH, з гідразином — гідразиди RCONHNH2, з карбоновими кислотами і ацеталями (у присутності мінеральних кислот) відбувається обмінна реакція. Взаємодія Е. з реактивом Гриньяра та іншими металоорганічними сполуками призводить до утворення третинних (у разі форміатів — вторинних) спиртів:
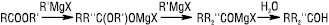
Е. мінеральних і фторзаміщених карбонових кислот використовують як алкілувальні речовини, що пов’язано з підвищеною стійкістю аніонів кислот:
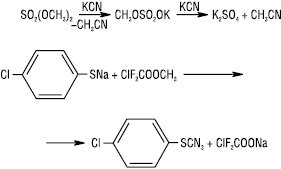
Середні Е. сульфатної кислоти мають більшу реакційну здатність, ніж алкілсульфатної. При наявності рухливих атомів гідрогену в α-положенні до карбоксильної групи Е. вступають у ряд реакцій конденсації з утворенням вуглець-вуглецевого зв’язку. Це взаємодія з альдегідами, реакції Кневенагеля і Манніха та ін. У присутності NaNH2 або алкоксидів металів Е. здатні конденсуватися з утворенням Е. β-кетокислоти (конденсація Кляйзена). Складноефірна конденсація застосовується для промислового добування ацетооцтового ефіру. Діестери двоосновних кислот зазнають внутрішньомолекулярної конденсації (реакція Дікмана). При дії дрібнодисперсного натрію в інертній атмосфері Е. реагують з утворенням α-гідроксикетонів (ацилоїнів):
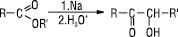
Е. стійкі до дії окиснювачів. Їх відновлення (Na в C2H5OH, LiAlH4, AlH3 та інші) приводить до альдегідів і далі — до первинного спирту. Каталітичне гідрування Е. (Kt — хромат (ІІІ) міді, T = 200–300, Р 10–30 МПа) є промисловим способом одержання спиртів. При T >300 °С Е. розкладаються, утворюючи алкени та кислоти:

Основним продуктом при піролізі метилових ефірів жирних кислот є формальдегід: RCOOCH3 > CH2O + RCOOH. А піроліз Е. жирних кислот у присутності деяких металів (Mg, Zn) спричиняє утворення кетонів:
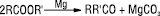
Для одержання Е. широко застосовують етерифікацію — взаємодію кислоти і спирту. Ця реакція є зворотною, на швидкість досягнення межі етерифікації впливають температура і каталізатори (кислоти, ангідриди, кислі солі і кислі катіонообмінні смоли):

Найлегше етерифікуються первинні спирти, найважче — третинні. Лактони (циклічні Е.) дуже легко утворюються при внутрішньомолекулярній етерифікації γ- і δ-гідроксикарбонових кислот. Е. можуть бути отримані ацилюванням спиртів і фенолів ангідридами чи галогенангідридами кислот, а також кетенами, напр.:

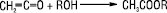
Е. одержують каталітичним алкілуванням кислот або їх солей алкілгалогенідами, алкенами, діазосполуками тощо. Поширеним способом одержання Е. є переетерифікація: взаємодія Е. зі спиртами, карбоновими кислотами або іншими Е. у присутності алкоголятів, лугів, HCl, BF3, солей деяких металів. Метод використовують при неможливості синтезу Е. реакцією етерифікації, напр. вінілові та ізопропілові Е. найвищих кислот.
Е. можуть бути одержані також кислотним алкоголізом нітрилів (Kt — H2SO4, HCl, п-толуолсульфокислота):
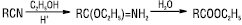
з альдегідів за реакцією Тищенка:
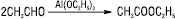
окисненням альдегідів, кетонів, ацеталей Н2О2 або надкислотами (реакція Байєра — Віллігера):
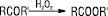
Е. вищих дикарбонових кислот можуть бути отримані із солей кислих Е. дикарбонових кислот за умовами електрохімічного синтезу Кольбе:
2ROOC(CH2)nCOONa 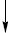 ROOC(CH2)2nCOOR
ROOC(CH2)2nCOOR
Е. сульфатної і фосфатної кислот одержують окисненням відповідних сульфітів і фосфатів.
Е. широко представлені у природі серед таких класів сполук, як жири, олії, воски, які входять до складу біомембран клітин; у рослинному світі — це складова ефірних олій (які обумовлюють їх приємний запах) та рослинних жирів, танінів. З лишайників можна виділити Е. ароматичних карбонових кислот і фенолів, які називають депсидами. Мікроорганізми виробляють безліч сполук, які містять ефірні зв’язки, напр. еритроміцин, динактин, важливих завдяки їх бактерицидним властивостям. Існують природні Е. з інсектицидними властивостями — це піретрини, які містяться в Chrysanthemum cinerariaefolium. Е. сульфатної кислоти є структурними елементами полісахаридів сполучної тканини (хондроїтинсульфатами). Е. холіну та оцтової кислоти є ацетилхолін — найбільш поширений посередник при передачі нервового збудження в нервових тканинах (нейромедіатор).
Естери застосовують як ЛП: нітрогліцерин, пентаеритритилу тетранітрат — нітровазодилататори; бусульфан — спазмолітик; бензокаїн, прокаїн — місцеві анестетики. Крім того, Е. є вихідними сполуками у виробництві багатьох фармацевтичних препаратів (напр. похідних саліцилової кислоти — метилсаліцилату, фенілсаліцилату, ацетилсаліцилової кислоти). Е. використовують як допоміжні речовини для фармацевтичної промисловості (емульгатори, емульсійні мазеві основи, згущувачі тощо). Етилацетат є розчинником для лікарських форм прогестерону, естрадіолу, тестостерону пропіонату.
Технічне використання Естерів дуже різноманітне. У промисловому органічному синтезі їх застосовують як проміжні продукти багатьох виробництв: Е. сульфатної кислоти — алкілувальні реагенти, деякі солі Е. сульфатної кислоти використовують для надання вогнестійкості паперу. Е. фосфорних кислот є інсектицидами, флотореагентами, пластифікаторами, присадками до олій. Нижчі Е. карбонових кислот, які мають приємний фруктовий запах, використовують у парфумерії та харчовій промисловості для одержання есенцій (з етилформіату — ромової; з етилбутирату — ананасової; з ізоамілбутирату — грушевої; з алкілізовалеріату — яблучної; з бензилацетату — жасминової; з н-октилацетату — апельсинової), а також як розчинники та екстрагенти. На основі поліестерів поліфункціональних кислот (головним чином фталевих) і багатоатомних спиртів виробляються численні смоли і синтетичні волокна. Ненасичені Е. (напр. метилметакрилат) використовують для виробництва органічного скла.
Жогло Ф., Возняк В., Попович В., Богдан Я. Допоміжні речовини та їх застосування в технології лікарських форм. — Львів, 1996; Нейланд О.Я. Органическая химия. — М., 1990; Общая органическая химия: В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 4. Карбоновые кислоты и их производные. Соединения фосфора / Под ред. О.И. Сазерленда. — М., 1983; Эппликвист Д., Де Пюи Ч., Райнхарт К. Введение в органическую химию. — М., 1985.
