ЕЛЕКТРОДИ ЕЛЕКТРОХІМІЧНІ (грец. elektron — бурштин + hodos — дорога, шлях) — електронні провідники струму (метали, графіт), які контактують з іонними провідниками струму (електролітами). При будь-якому електрохімічному процесі в електрохімічній комірці повинно бути не менше двох Е.е., занурених в один і той же електроліт або в різні, які контактують між собою. Проходження струму через таку систему супроводжується зміною виду носія струму на міжфазній межі електрод — електроліт. Безперервне проходження струму через міжфазну мережу забезпечується електрохімічною реакцією в ній. Е.е., до якого під дією зовнішнього струму переміщуються позитивно заряджені іони (катіони), називають катодом. Катіони приймають з катода електрони і відновлюються на ньому. Е.е., до якого під дією зовнішнього струму переміщуються негативно заряджені іони (аніони), називають анодом. Аніони віддають електрони анода й окиснюються на ньому. Перебіг таких електрохімічних реакцій на катоді та аноді може проходити як за участю, так і без участі матеріалу Е.е.
Класифікація Е.е. Е.е. 1-го роду — металеві або газові, занурені у розчин електроліту, що містить іони матеріалу Е.е. Такі Е.е. оборотні до цих іонів. Напр. на срібному Е.е. Ag|Ag+ відбувається потенціалотвірна реакція: AgDAg+ + 1ē. Рівняння Нернста для такого Е.е. має вигляд:
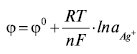 ,
,
де n — кількість електронів, які беруть участь у реакції; aAg+ — активність іонів срібла у розчині.
У газових Е.е. роль металу повинні відігравати електрохімічно активні гази (водень, хлор, кисень та ін.), але вони не є електронними провідниками струму, тому електричний контакт у газових Е.е. здійснюється за допомогою інертних металів (платини, золота, паладію), які служать передавачами електронів від молекул газів до іонів розчину та навпаки. Напр. хлорний електрод Pt, Cl2|Cl– являє собою платинову пластинку, яка занурена у розчин з Сl–-іонами й омивається рівномірним потоком газу Cl2 з тиском РCl2. Газ Cl2 адсорбується на платиновій пластинці, потім дисоціює на атоми Clадс, які вже беруть безпосередню участь в електрохімічній реакції: Cl2  2Clадс
2Clадс  2Cl– + 2ē.
2Cl– + 2ē.
Рівняння Нернста для такого Е.е. має вигляд:
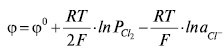 ,
,
де aCl–– активність Сl– у розчині.
До Е.е. 1-го роду належать також амальгамні Е.е., напр. натрієвий амальгамний Е.е., в якому роль металевого Е.е. відіграє амальгама натрію. На такому Е.е. потенціалотвірна реакція проходить таким чином: Na+ + ē(Hg)  Na(Hg).
Na(Hg).
Рівняння Нернста для такого Е.е. має вигляд:
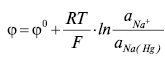 ,
,
де aNa+, aNa(Hg) — активність Na+ у розчині та в амальгамі відповідно.
Е.е. 2-го роду — це метали, покриті шаром своєї важкорозчинної солі й занурені у розчин електроліту, який містить загальний аніон з важкорозчинною сіллю. До цієї групи належать Е.е. порівняння — хлорсрібний (Ag, AgCl|Cl–), каломельний (Hg, Hg2Cl2|Cl–), сульфатртутний (Hg, HgSO4|SO42–). Потенціалотвірна реакція, напр. на хлорсрібному Е.е., проходить таким чином: AgCl + ē  Ag + Cl–.
Ag + Cl–.
Рівняння Нернста для такого Е.е. має вигляд:
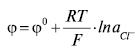 ,
,
тобто Е.е. 2-го роду оборотні до аніона.
Е.е. 3-го роду — це метали, покриті двома шарами двох важкорозчинних солей. Перша сіль менше розчинна, ніж друга, й утримує катіон металу Е.е. Друга сіль більше розчинна, ніж перша, утримує той самий аніон, що й перша. Напр. оксалатний Е.е. 3-го роду Ag, Ag2C2О4, CaC2O4|Ca2+.
Потенціалотвірна реакція на такому Е.е. проходить таким чином: Ag2C2О4 + 2ē + Са2+ 2Ag + CаС2О4.
2Ag + CаС2О4.
Рівняння Нернста для цього Е.е. має такий вигляд:
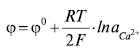 ,
,
тобто Е.е. 3-го роду оборотні до катіона.
Окисно-відновні Е.е. (редокс-Е.е.) — це метали, матеріал яких не бере участі в електрохімічній реакції, а лише виконує роль передавача електронів від відновленої форми до окисненої або навпаки. Напр.: Fe3+ + 1ē  Fe2+. У такій реакції окисно-відновний Е.е. здійcнює перенесення електронів між цими іонами. Рівняння Нернста для цих Е.е. має такий вигляд:
Fe2+. У такій реакції окисно-відновний Е.е. здійcнює перенесення електронів між цими іонами. Рівняння Нернста для цих Е.е. має такий вигляд:
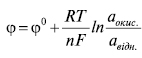 ,
,
де аокис., авідн. — активність окисненої та відновленої форм відповідно; n — кількість електронів, яка бере участь в окисно-відновній реакції.
Модифіковані Е.е. — Е.е., поверхню яких модифікують за допомогою фізичних або хімічних методів з метою надання їй певних характеристик. Напр. при фізичній модифікації проводять іонну імплантацію, розпушення поверхні або вирощування на ній монокристалічних структур тощо. При хімічній модифікації поверхню Е.е. покривають органічними, металоорганічними або неорганічними шарами, створюють на поверхні Е.е. композити з електродних матеріалів, змінюють хімічний склад поверхні Е.е. тощо. Зокрема, хімічною модифікацією поверхні іоноселективних Е.е. з функціями неорганічних іонів були одержані іоноселективні Е.е. з функціями органічних іонів лікарських речовин: прокаїну, лідокаїну, диклофенаку натрію та ін.
Конструкції та розмір Е.е. різноманітні. Вони бувають у вигляді стрижня, пластинки, кульки, сітки і т.п. Поверхня ультрамікроелектродів не перевищує 10–14 м2. Е.е., які використовують в електроаналітичних методах аналізу, мають поверхню близько 10–5 м2; Е.е., які використовують в електрохімічному синтезі лікарських речовин, напр. глюконату кальцію, мають поверхню понад 10–2 м2.
Див. також Іоноселективні електроди.
Багоцкий В.С. Основы электрохимии. — М., 1988; Дамаскин Б.Б., Петрий О.А. Электрохимия. — М., 1987; Физическая химия / Под ред. Б.П. Никольского. — Л., 1987.
