ТРАНСЛЯЦІЯ (лат. translatio — передача, переміщення) — процес біосинтезу білка, тобто другий етап реалізації генетичної інформації, який полягає в переведенні нуклеотидної послідовності матричної РНК (мРНК) в амінокислотну послідовність білка, тобто відбувається переклад інформації з «мови» нуклеотидної послідовності мРНК на «мову» амінокислотної послідовності білка. Оскільки з 4 видів нуклеотидів можна отримати 64 (43) різних комбінації по 3 нуклеотиди, було зроблено висновок (Г. Гамов, 1954 р.) про існування щонайменше 64 «кодових слів» для 20 амінокислот. Такий спосіб записування генетичної інформації одержав назву генетичного коду, який був повністю розшифрований у 60-х роках ХХ ст. М. Ніренбергом, Г. Маттеї, Г. Кораною та ін. Було встановлено, що з 64 комбінацій нуклеотидів 61 кодон є змістовним (визначає включення до складу білка певної амінокислоти), а 3 кодони — беззмістовні (не кодують жодної з амінокислот). Ці нонсенс-кодони (УАА, УАГ, УГА) виконують роль сигналів термінації Т. Нуклеотидна послідовність молекули мРНК містить кодони для кожної амінокислоти. Адапторами транслюючих послідовностей кодонів в амінокислотну послідовність білка є молекули транспортних РНК (тРНК), що визначається їх структурою. У складі молекул тРНК є 3′-кінець, що зв’язується з амінокислотою, і антикодон — ділянка з 3 нуклеотидів, яка розпізнає в мРНК триплет, що кодує цю амінокислоту. Передача інформації під час Т. здійснюється за матричним механізмом, і роль безпосередньої матриці при цьому виконує молекула мРНК. У молекулі мРНК містяться триплети (кодони), у нуклеотидній послідовності яких закодована інформація про первинну структуру поліпептидного ланцюга, одержана мРНК від ДНК при транскрипції. Процес синтезу білка — найбільш складний із біосинтетичних процесів: в еукаріотичних клітинах у ньому беруть участь понад 70 різних рибосомних білків; не менше 20 ферментів, необхідних для активації амінокислот, більше 10 білкових факторів ініціації, елонгації й термінації синтезу поліпептидних ланцюгів, не менше 100 додаткових ферментів, які беруть участь у посттрансляційних модифікаціях білків, понад 70 видів транспортних і рибосомних РНК (рРНК). Синтез білка відбувається в декілька основних етапів. Першим етапом є активація й відбір амінокислот. На цьому етапі, що відбувається в цитозолі клітин, кожна з 20 амінокислот ковалентно приєднується до відповідної тРНК за допомогою ферменту аміноацил-тРНК-синтетази з утворенням аміноацил-тРНК. Після активації молекули аміноацил-тРНК дифундують до рибосом, на яких проходить біосинтез білка. У процесі Т. розрізняють 3 основні етапи: ініціацію (початок синтезу поліпептидного ланцюга), елонгацію (його подовження) і термінацію (завершення синтезу). Для ініціації синтезу білка в еукаріотів необхідна наявність 40S- та 60S-субодиниць рибосоми, мРНК, факторів ініціації (eIF-1, eIF-2, eIF-3 тощо — всього відомо до десяти факторів ініціації), ініціюючої аміноацил-тРНК (в еукаріотів — метионін-тРНК, або мет-тРНК, у прокаріотів — N-формілметіонін-тРНК), ГТФ і АТФ як джерел енергії. У процесі ініціації відбувається утворення ініціюючого комплексу. На цьому етапі 40S-субодиниця рибосоми з’єднується з фактором ініціації, що перешкоджає її зв’язуванню з 60S-субодиницею, але стимулює об’єднання з потрійним комплексом, до якого входять: мет-тРНК, eIF-2 і ГТФ. Потім цей ще складніший комплекс зв’язується з 5′-кінцем мРНК за участю декількох eIF. Приєднавшись до мРНК, 40S-субодиниця пересувається по некодуючій частині мРНК, доки не досягне ініціюючого кодону АУГ, який відповідає ініціюючій амінокислоті метіоніну. Цей процес супроводжується гідролізом АТФ. Досягнувши початку кодуючої послідовності мРНК, 40S-субодиниця зупиняється і зв’язується з іншими факторами ініціації, які прискорюють приєднання 60S-субодиниці й утворення 80S рибосоми за рахунок енергії гідролізу ГТФ. При цьому формуються А- і Р-центри рибосоми; у Р-центрі знаходиться АУГ-кодон мРНК, до якого приєднана мет-тРНК, а в А-центрі — триплет, який кодує включення другої амінокислоти до білка, що синтезується. Далі починається найтриваліший етап білкового синтезу — елонгація. На цьому етапі поліпептидний ланцюг подовжується за рахунок послідовного ковалентного приєднання амінокислот, кожна з яких доставляється до рибосоми і вбудовується в певне положення за допомогою відповідної тРНК, яка утворює комплементарні пари з відповідним їй кодоном у мРНК. Включення амінокислоти в білок відбувається протягом трьох стадій: перша стадія — зв’язування аміноацил-тРНК кожної амінокислоти, що входить до білка з А-центром рибосоми (рисунок); друга — стадія транспептидації, в якій спочатку метіонін, а далі пептид, які знаходяться в Р-центрі, приєднуються до α-NH2-групи аміноацильного залишку аміноацил-тРНК А-центру з утворенням пептидного зв’язку.
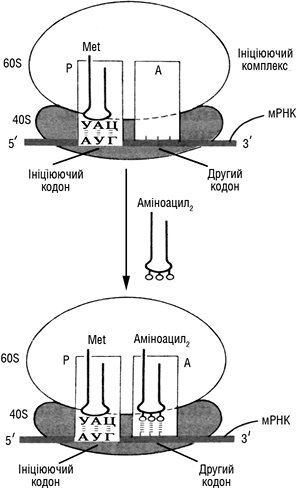
Рисунок. Перша стадія елонгації — зв’язування другої аміноацил-тРНК
Нарешті, третя стадія елонгації — транслокація; у цій стадії подовжена на один амінокислотний залишок пептидил-тРНК переміщується із А-центру в Р-центр унаслідок транслокації рибосоми. Елонгація забезпечується специфічними факторами та ГТФ. Термінація Т. відбувається, коли транслююча рибосома у своєму переміщенні впродовж ланцюга мРНК досягає одного з термінуючих кодонів (нонсенс-кодонів) — УАА, УАГ або УГА, які служать сигналами закінчення синтезу поліпептидного ланцюга. Вони розпізнаються факторами термінації, які каталізують гідролітичне відщеплення синтезованого поліпептиду від кінцевої тРНК, звільнення його та кінцевої тРНК і мРНК від рибосоми, дисоціацію рибосоми на субодиниці. Майже завжди мРНК транслюється одночасно багатьма рибосомами. Така структура називається полірибосомою (полісомою). Поліпептидний ланцюг набуває своїх біологічних властивостей після утворення унікальної просторової конформації білкової молекули, тому в багатьох випадках передує його посттрансляційна модифікація.
У клінічній практиці, а також в експериментальній біології та медицині широко застосовують антибіотики, які є інгібіторами процесу Т. на різних його етапах у прокаріотичних та еукаріотичних організмів. Стрептоміцин (інгібітор ініціації) зв’язується з 30S-субодиницею рибосом прокаріотів і порушує правильне зчитування мРНК. Інгібітори елонгації: хлорамфенікол (Левоміцетин) сполучається з 50S-субодиницею рибосом прокаріотів і гальмує пептидилтрансферазну активність; тетрацикліни гальмують Т., блокуючи зв’язування аміноацил-тРНК в А-центрі рибосом. Циклогексимід діє аналогічним чином, але на фермент еукаріотів. Пуроміцин перериває елонгацію поліпептидного ланцюга у прокаріотів і еукаріотів. Еритроміцин зв’язується з 50S-субодиницею рибосом і блокує стадію транслокації. Антибіотики, що є інгібіторами процесів Т. у прокаріотів, застосовуються як антибактеріальні ЛП у терапії інфекційних та інших захворювань.
Биохимия / Под ред. Е.С. Северина. — М., 2003; Гонський Я.І., Максимчук Т.П. Біохімія людини. — Тернопіль, 2001; Губський Ю.І. Біологічна хімія. — К. — Тернопіль, 2000.
