ТІОЛИ (меркаптани) — похідні вуглеводнів, у молекулах яких один або декілька атомів гідрогену заміщені меркаптогрупою –SH (тіольною, сульфгідрильною). Т., в яких меркаптогрупа сполучена з аліфатичним радикалом, називають тіоспиртами, з ароматичним — тіофенолами.
За номенклатурою IUPAC назву Т. утворюють додаванням суфікса -тіол до назви відповідного вуглеводню у разі, якщо –SH — головна група. Якщо –SH — не головна група, застосовують префікс меркапто-, напр., CH3SH — метантіол, CH3CH(CH3)CH2SH — 2-метилпропантіол-1, HSCH2CH2SH — етандитіол-1,2, C6H5SH — меркаптобензол або тіофенол.
У меркаптогрупі гібридизація атома S проміжна між sp2 і sp3, напр., для CH3SH довжина зв’язків: (нм) 0,1817 (C–S), 0,1329 (S–H), кут CSH — 96,5°; енергія зв’язку — S–H 360 кДж/моль. Група SH проявляє слабкий негативний індуктивний і позитивний мезомерний ефект. Кислотні властивості її вищі, а основні — нижчі, ніж групи ОН. Т., за винятком CH3SH (газ), — рідкі або тверді речовини, їх Тпл та Ткип нижча, ніж у гідроксіаналогів, що пов’язано з меншою електронегативністю атома сульфуру порівняно з оксигеном і, відповідно, — меншою схильністю до утворення водневих зв’язків. У концентрованих розчинах Т. існують у вигляді димерів переважно лінійної будови завдяки водневим зв’язкам S–H···S; у рідкому і твердому стані можуть утворюватися полімери. Нижчі аліфатичні Т. мають різкий неприємний запах; як правило, сполуки отруйні.
Реакційна здатність Т. визначається наявністю рухливого атома гідрогену і неподілених пар електронів у атома S. Електродонорні (нуклеофільні) властивості сульфуру вищі, ніж оксигену, внаслідок збільшення атомного радіуса й віддалення електронів від ядра. Т. характерна висока нуклеофільність у поєднанні з відносно низькою основністю. Т. — слабкі кислоти, рКа 10–11 (25 °С, вода), утворюють солі — тіоляти (меркаптиди) не тільки з лужними металами, а й з іонами важких металів:
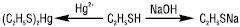 .
.
Т. вступають у реакції за участю тіолят-іона, напр.:

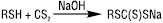
За наявності пероксидів, діазосполук тощо або під дією УФ-випромінювання Т. приєднуються до алкенів за місцем розриву подвійного зв’язку з орієнтацією проти правила Марковникова. Реакція проходить за механізмом АR:
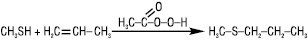
Гетеролітичне приєднання Т. до активованих олефінів відбувається також проти правила Марковникова та за наявності основ. Продуктами взаємодії Т. з нітрилами в кислому середовищі є імінотіоестери R(R′S)C=NH; з альдегідами або кетонами — відповідні тіоацеталі й тіокеталі:
 .
.
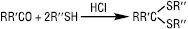
Ацилювання Т. ацилгалогенідами або карбоновими кислотами призводить до утворення тіоестерів:
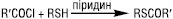 .
.
В основних та нейтральних середовищах Т. розщеплюють оксиранові чи тіїранові цикли:
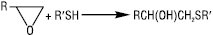
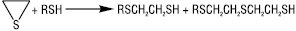
Нітрозуючі агенти (NOCl, HNO2) при взаємодії з Т. утворюють нестійкі тіонітрити RSNO, які мають характерне забарвлення, що є кольоровою пробою на Т. У газовому середовищі при 400 °С Т. розкладаються на H2S і відповідний алкен. Т. за м’яких умов легко окиснюються до дисульфідів RSSR (напр. при дії О2 у лужному середовищі, йоду, CuCl2 та ін.), при дії сильних окисників (KMnO4, HNO3, HOI) утворюються сульфокислоти RSO3H:
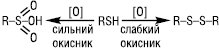
Велике біологічне значення має легкість і зворотність взаємоперетворення й сульфгідрильних дисульфідних груп:
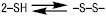 .
.
Меркаптогрупу містить одна з найважливіших сірковмісних амінокислот — цистеїн, яка входить до складу білків і утворює при м’якому окисненні свій дисульфідний аналог — цистин:
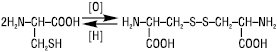
У білковій молекулі дисульфідні зв’язки –S–S– відіграють роль своєрідних містків, які скріплюють окремі фрагменти поліпептидного ланцюга, внаслідок чого виникає відповідна конфігурація ланцюга, необхідна для виконання білком своїх функцій.
Основними методами добування аліфатичних Т. є взаємодія NaSH або KSH з алкілуючими реагентами (RHal, (RO)2SO2 та ін.); приєднання H2S до алкенів; обробка спиртів H2S за наявності Al2O3 або ThO2 (Т 350–400 °С). Для синтезу третинних Т. застосовують реактиви Гріньяра:
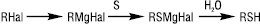
Тіофеноли одержують в основному непрямими методами з використанням металорганічних сполук або з первинних ароматичних амінів через відповідні діазонієві солі, напр.:
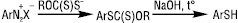
Розроблено спосіб добування тіофенолів реакцією хлораренів з H2S чи алкантіолами в газовій фазі Т 500–620 °С); також реакцією ароматичних вуглеводнів, які містять електродонорні замісники, із сірковмісними електрофілами:
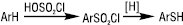
Т. відіграють важливу роль у біохімії клітини, їх використовують для синтезу органічних сполук (пестицидів, полімерів), ЛП (C2H5SH застосовують у виробництві снодійних препаратів — напр. сульфоналу, CH3SH — для виробництва метіоніну). Т. застосовують у медицині як антидоти при отруєнні важкими металами (напр. унітіол — натрієва сіль 2,3-димеркаптопран-1-сульфокислоти, меркаптид — β,γ-димеркаптопро-піл-n-толілсульфід, БАЛ-2,3-димеркаптопропанол).
Т. (C8-16), які є уловлювачами для радикалів, використовують для захисту від радіації і як антиокисники (напр. додекантіол — стабілізувальна добавка для каучуків). Нижчі Т. додають до природного газу як одоранти з метою виявлення витоку газу в газопровідних мережах (запах Т. виявляється в повітрі в кількості однієї частини метантіолу на 5·1010 частин повітря). Крім того, тіофенол — компонент віддушок у харчовій промисловості та парфумерії.
Общая органическая химия: В 12 т. / Под общ. ред. Д. Бартона, У.Д. Оллиса. — Т. 5. Соединения фосфора и серы. — М., 1983; Черних В.П. Зіменковський Б.С., Гриценко І.С. Органічна хімія / За заг. ред. В.П. Черних. — Х., 2008.
