ХЛОР, Cl (Chlorum < грец. chlуros — зелений) — хімічний елемент VII А групи третього періоду періодичної системи Д.І. Менделєєва; ат. н. 17, ат. м. 35,453. У вільному стані за нормальних умов Х. двоатомний газ. Вміст Х. у земній корі становить 4,5⋅10–2%. Внаслідок високої реакційної здатності Х. у вільному стані зустрічається лише у вулканічних газах. У зв’язаному вигляді Х. входить до складу мінералів, найважливіші з яких — кам’яна сіль NaCl, сильвініт NaCl⋅KCl, карналіт KCl⋅MgCl2⋅6H2O. Велика кількість Х. міститься в морській воді. Атом Х. має електронну конфігурацію 3s23p5. У сполуках виявляє ступені окиснення –1 (напр. HCl), +1 (напр. HClO), +3 (напр. HClO2), +5 (напр. HClO3), +7 (напр. HClO4). Х. — жовто-зелений газ, який має різкий специфічний запах і чинить подразнювальну дію на слизові оболонки дихальних шляхів; у 2,5 раза важчий за повітря. При звичайній температурі легко переходить у рідкий стан під дією тиску, тому в продаж надходить у рідкому стані в стальних цистернах. Х. добре розчинний у воді, хімічно дуже активний, безпосередньо сполучається з більшістю металів та неметалів, заміщує гідроген у вуглеводнях і приєднується до ненасичених сполук СО, С2Н4 та ін. З киснем, азотом, вуглецем та інертними газами безпосередньо не реагує, за відсутності води не реагує з залізом, що дає можливість перевозити Х. у стальних балонах. Сполуки Х. з оксигеном, нітрогеном і карбоном одержують непрямим шляхом. Відомі оксиди Х. Cl2O, ClO2, Cl2O6, Cl2O7 і оксигенвмісні кислоти: гіпохлоритна HClO, хлоритна HClO2, хлоратна HClO3, перхлоратна HClO4. Кислотність та окисна здатність оксигенвмісних кислот змінюється таким чином:
посилення кислотних властивостей
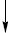
HClO HClO2 HClO3 HClO4
посилення окисних властивостей
Гіпохлоритна кислота HClO легко розкладається:
HClO→HCl+1/2O2.
На цьому ґрунтується застосування сполук Х. для відбілювання та дезінфекції. Х. легко вступає у взаємодію з лугами, при цьому на холоді утворюються хлориди і гіпохлорити, а при нагріванні — хлориди і хлорати. З Ca(OH)2 Х. утворює важливі технічні продукти — хлорне вапно (CaOCl2) кальцію хлорит-гіпохлорит. Основний метод одержання Х. — електроліз розчинів натрію хлориду. Сумарний процес електролізу має вигляд:
2NaCl + 2H2O = Cl2 + 2NaOH + H2.
У медичній практиці використовують сполуки Х. — хлоридну кислоту при захворюваннях шлунка, що супроводжуються зниженням кислотності, хлорне вапно та кальцію гіпохлорит для дезінфекції. Х. та його сполуки застосовують як відбілюючу речовину у паперовій та текстильній промисловості, а також для синтезу хлорорганічних сполук.
Краткая химическая энциклопедия / Под ред. И.Л. Кнунянц: В 5 т. — М., 1967. — Т. 5; Левітін Є.Я. Загальна та неорганічна хімія. — Х., 2000.
