БЛАГОРОДНІ ГАЗИ (ІНЕРТНІ, РІДКІСНІ) — хімічні елементи головної підгрупи восьмої групи періодичної системи елементів Д.І. Менделєєва: Гелій (Не), Неон (Ne), Аргон (Аr), Криптон (Kr), Ксенон (Хе), Радон (Rn). Раніше їх називали інертними газами за хімічну інертність елементів підгрупи. На основі цього їх розміщали в окремій «нульовій» групі періодичної системи. Але така назва проіснувала тільки до початку 60-х років ХХ ст., коли канадським хіміком Н. Бартлеттом вперше було синтезовано сполуку ксенону з PtF6 складу ХеРtF6. Б.г. були відкриті у 1892–1908 рр. Гелій вперше виявлено на Сонці методом спектрального аналізу (1868). Б.г. постійно присутні у повітрі, незначна кількість наявна в бурових і мінеральних водах, підземних газах (таблиця).
Таблиця. Деякі властивості Б.г.
| Ат. н. елемента | Елемент | Радіус атома, нм |
Потенціал іонізації, єВ |
Температура, °С | Масова частка в земній корі, % | Вміст у м3 повітря, см3 | Розчинність у 1 л води при 0 °С, мл | |
| плавлення | кипіння | |||||||
| 2 | Гелій | 0,122 | 24,58 | –272 | –269 | 8⋅10–7 | 5 | 10 |
| 10 | Неон | 0,160 | 21,56 | –249 | –246 | 5⋅10–7 | 18 | 14 |
| 18 | Аргон | 0,192 | 15,76 | –189 | –186 | 35⋅10–5 | 930 | 52 |
| 36 | Криптон | 0,198 | 13,99 | –157 | –153 | 19⋅10–9 | 1 | 99 |
| 54 | Ксенон | 0,218 | 12,13 | –112 | –108 | 29⋅10–10 | 0,08 | 203 |
| 86 | Радон | 0,214 | 10,75 | –71 | –62 | 4⋅10–7 | Практично відсутній | 510 |
Гелій разом із Гідрогеном — найбільш розповсюджені елементи Космосу. Накопичування ядер Не у Всесвіті зумовлене термоядерною реакцією: 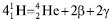 . У земній корі Не накопичується за рахунок α-розпаду радіоактивних елементів. Радон — радіоактивний елемент і один з рідкісних елементів. Найбільшу кількість Б.г. для наукових і технічних цілей одержують фракційною перегонкою рідкого повітря. Б.г. — безбарвні речовини, без запаху і смаку, малорозчинні у воді. Їх розчинність зростає зі збільшенням заряду ядра атома (див. таблицю). Радон належить до добрерозчинних газів.
. У земній корі Не накопичується за рахунок α-розпаду радіоактивних елементів. Радон — радіоактивний елемент і один з рідкісних елементів. Найбільшу кількість Б.г. для наукових і технічних цілей одержують фракційною перегонкою рідкого повітря. Б.г. — безбарвні речовини, без запаху і смаку, малорозчинні у воді. Їх розчинність зростає зі збільшенням заряду ядра атома (див. таблицю). Радон належить до добрерозчинних газів.
Атоми Б.г. мають завершену конфігурацію зовнішнього енергетичного рівня ns2 np6 i 1s2 у гелію як елемента першого періоду. Відповідно до електронної конфігурації Б.г. їх молекули одноатомні. Наявність стійкої електронної конфігурації зумовлює не тільки високий потенціал іонізації та хімічну інертність Б.г., але й важкість їх одержання у рідкому та твердому станах. Наявність d-орбіталей на валентному рівні аргону, криптону, ксенону і радону свідчить про можливість їх існування у збудженому стані. Дослідження хімічних властивостей Б.г. показало, що в ряду He-Ne-Ar-Kr-Xe-Rn підвищується здатність до утворення молекулярних сполук. Аргон, криптон і ксенон утворюють гідрати типу включення: Ar⋅6H2O, Kr⋅6H2O і Xe⋅6H2O. Це кристалічні речовини, які розкладаються відповідно при –43, –28 і 4 °С. З деякими органічними сполуками Б.г. утворюють сполуки включення — клатрати: Rn⋅3C6H5OH, Rn⋅2C6H5CH3, Rn⋅3ClC6H4O6. У хімічних сполуках Б.г. виявляють ступені окиснення +2, +4, +6 і навіть +8. Такі сполуки одержані при взаємодії ксенону з флуором: XeF2, XeF4, XeF6. При дії води на XeF4 утворюється ксенону (IV) гідроксид. Відомі також ксенону (IV) оксофлуорид, ксенону (VI) оксид і кислоти складу: H4XeO5, H2XeO4 i H6XeO6. При дії озону на сполуки ксенону (VI) добувають похідні Xe (VIII) — перксенонати:
XeO3 + O3 + 4NaOH = Na4XeO6 + O2 + 2H2O.
З барій перксенонату, одержують ксенону (VIII) оксид:
Ba2XeO6 + 2H2SO4 = XeO4 + 2BaSO4↓ + 2H2O.
Ксенону оксиди (XeO3, XeO4) мають кислотні властивості. В останні роки одержана велика кількість сполук Kr, Xe i Rn. У зв’язку зі швидким радіоактивним розпадом радон та його сполуки одержано в незначній кількості, а їх склад встановлено приблизно.
Б.г. здатні утворювати хімічні сполуки з флуором і киснем. Ксенону флуориди використовують як енергійні окисники і фторуючі агенти в ракетному паливі. Гелій використовують при проведенні ядерних реакцій. Значна легкість та негорючість гелію зумовлює його застосування для наповнення аеростатів (замість водню). Аргон використовують для здійснення процесів, що потребують інертного середовища (плавлення металів, електрозварювання, вивчення кінетики та механізму електродних процесів тощо). Радон дуже токсичний, що пояснюється його радіоактивними властивостями. При розпаді утворює нелеткі радіоактивні продукти (ізотопи полонію, бісмуту та плюмбуму), які дуже важко виводяться з організму. Але Rn використовують у медичній практиці: води, до складу яких входить Rn (родонові ванни), застосовують для лікування серцево-судинної, нервової систем, органів дихання і травлення, кісток, суглобів і м’язів, гінекологічних захворювань, порушення обміну речовин тощо.
Ахметов Н.С. Общая и неорганическая химия. — М., 1988; Дяткина М.Е. Электронное строение соединений инертных газов // Журнал структурной химии. — 1969. — Т. 10. — № 1.
