БЕЗПЕКА ЛІКІВ — комплексне поняття, що містить забезпечення якості ліків на всіх етапах їх обігу, в т.ч. виробництво, транспортування, зберігання та раціональне застосування в медичній практиці з метою вилучення або мінімізації виникнення токсичних та побічних ефектів при роздільному та одночасному застосуванні з іншими ліками чи компонентами їжі. За визначенням МОЗ України (Наказ від 25.09.2009 р. № 543), Б.л. — це характеристика препарату, заснована на порівняльній оцінці користі й потенційної шкоди, що може бути завдана пацієнтові при застосуванні цього ЛП.
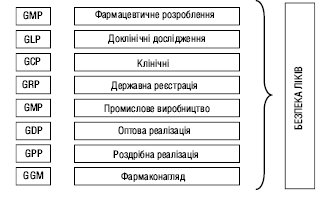
Б.л. формується на стадії фармацевтичного розроблення, забезпечується в процесі промислового виробництва, вивчається на стадії доклінічних і клінічних досліджень, оцінюється на етапі реєстрації, а моніторинг Б.л. проводиться протягом усього їх життєвого циклу (рисунок) (див. Фармакологічний нагляд).
Контроль за Б.л. як компонент системи безпеки існував ще в Древній Греції та Єгипті. У середні ІІ ст. н. е. в багатьох державах правом перевірки аптекарських товарів і знищення неякісної продукції користувалися члени визнаних медичних співтовариств. У 1864 р. питання Б.л. були висвітлені у Британській Фармакопеї, яка була першим документом з приведеними до єдиного стандарту вимогами до якості ліків і правилами їхнього призначення. У 1906 р. у США був прийнятий перший закон (Food and Drugs Act), який захищав споживачів від незаконного поширення на території країни несертифікованих і фальсифікованих продуктів, напоїв і ліків. З цього ж року розпочала відлік своєї історії найвідоміша у світі державна структура — Адміністрація з контролю якості харчових продуктів і ліків США (FDA). У 1938 р. у США в законодавчому акті «Federal Food, Drug and Cosmetіc Act» компанії-виробники зобов’язалися документально підтверджувати Б.л., які вони виробляли, перш ніж їх використовувати в медичній практиці. У 1963 р. на ХVІ Асамблеї ВООЗ було запропоновано країнам-учасникам організувати систематичний збір інформації про серйозні побічні реакції ліків під час їх використання, а в 1968 р. створюється Міжнародна програма моніторингу ліків (фармаконагляду), яка працює й нині.
Питання Б.л. у медичній практиці забезпечуються Формулярною системою (що є комплексом управлінських методик в охороні здоров’я, яка забезпечує використання раціональних методів і застосування ЛП з метою забезпечення максимально високої (за конкретних умов) якості медичної допомоги та оптимального використання наявних ресурсів). Основний принцип формулярної системи — застосування ліків із доведеною ефективністю їхньої дії при певному патологічному процесі; основні функції формулярної системи: медична (визначення й розроблення методів раціональної фармакотерапії розповсюджених захворювань), фармакологічна (забезпечення контролю за правильним використанням ліків і здійснення заходів щодо попередження й виправлення ятрогенних помилок), соціальна (забезпечення хворих якісним лікуванням), економічна (використання найбільш ефективних фармацевтичних препаратів), інформаційна (поширення об’єктивної інформації, заснованої на принципах доказової медицини) та професійно-освітня (позитивний вплив на підвищення кваліфікації лікарів у міжатестаційний період, передбачений вимогами МОЗ України).
Безопасность лекарств. Руководство по фармаконадзору / Под ред. А.П. Викторова, В.И. Мальцева, Ю.Б. Белоусова — К., 2007; Безопасность лекарств: от разработки до медицинскогго применения: Материалы 2-й науч.-практ. конф., Киев, 3–4 декабря, 2009. — К., 2009; Закон України «Про лікарські засоби» від 30.06.1999 р. № 783-XIV (783–14); Контроль якості лікарських засобів: сучасний стан і перспективи // Матеріали семінару на тему «Питання контролю якості лікарських засобів в Україні». — Х., 2005; Контроль за безпекою лікарських засобів: 10 років фармаконагляду України / О.П. Вікторов, О.В. Матвєєва, А.Г. Войтенко та ін. // Здоров’я. — 2007. — № 5; Наказ МОЗ України від 25.09.2008 р. № 543.
