ХЕМІЛЮМІНЕСЦЕНЦІЯ (хімічне світіння) — надлишкове порівняно з тепловим електромагнітне випромінювання оптичного діапазону електронно-збудженою молекулою або іоном під час перебігу хімічної реакції. Х. може виникати у будь-якій хімічній реакції, яка має елементарні екзотермічні акти з кількістю виділеної енергії, достатньої для електронного збудження. Світло можуть випромінювати реагуючі частинки, а також проміжні та кінцеві продукти. Реакції Х. зазвичай є окисно-відновними, їх механізм складний і для більшості систем недостатньо вивчений. У процесі реакції утворюється велика кількість нестійких короткоживучих продуктів, один з яких є продуктом, що знаходиться в електронно-збудженому стані. Перехід цього продукту в основний стан супроводжується випромінюванням видимого світла. Квантовий вихід люмінесцентних систем визначається ефективністю утворення електронно-збудженого продукту та квантовим виходом його флуоресценції (див. Флуоресценція). Значення його вимірюється відношенням кількості вилучених фотонів до кількості прореагованих молекул вихідних сполук. Х. найчастіше спостерігається у реакціях вільних радикалів або атомів і пов’язана зазвичай з актами рекомбінації (або диспропорціювання) та приєднання активних частинок до молекул. У рідинно-фазових реакціях Х. спостерігається головним чином в реакціях окиснення молекулярним оксигеном, гідроген пероксидом та іншими окисниками. Слабка Х. реєструється у біологічних системах — рослинах і тканинах органів тварин (самовільна Х.) (див. Біохемілюмінесценція), у реакціях окиснення великого кола вуглеводнів, алкоголів, кетонів, кислот, полімерних матеріалів тощо. Прикладами хемілюмінесцентних реакцій за участю твердих тіл є окиснення білого фосфору і силоксену (див. Хемілюмінесцентні індикатори), рекомбінація радикалів на поверхні (так звана кандолюмінесценція).
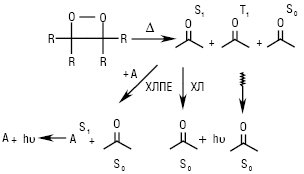
Рисунок. Схема перенесення електронної енергії при розкладанні 1,2-діоксетанів (ХЛ — пряма Х., ХЛПЕ — Х. з перенесенням енергії)
Більшість хемілюмінесцентних реакцій органічних сполук передбачає утворення ключової проміжної сполуки одного типу, а саме — заміщеного чотиричленного 1,2-діоксетану. Дисоціація цього ключового інтермедіату призводить до електронно-збуджених карбонільних сполук, обумовлюючи Х. у системі. 1,2-Діоксетани дуже лабільні — термічно нестійкі, розкладаються на дві карбонільні сполуки, одна з яких може бути в першому синглетному (S1) або триплетному (Т1) електронно-збудженому стані. Збуджений стан може випромінювати світло при переході в основний стан або безпосередньо (пряма Х.), або шляхом перенесення до акцепторної люмінесціюючої молекули А — сенсибілізатора (див. Фізичні активатори) (Х. з перенесенням енергії) (рисунок). Пряма Х. 1,2-діоксетанів зазвичай дуже слабка. Це пов’язано з тим, що більшість кетонів, естерів і альдегідів, які є продуктами дисоціації 1,2-діоксетанів, мають низьку ефективність до флуоресценції (див. Флуоресценція). Тому для посилення власної слабкої Х. систем використовують хемілюмінесцентні індикатори.
Бабко А.К., Дубовенко Л.І., Луковская Н.М. Хемилюминесцентный анализ. — К., 1966; Владимиров Ю.А. Активированная хемилюминесценция и биолюминесценция как инструмент в медико-биологических исследованиях // Соросовский образовательный журнал. — 2001. — Т. 7. — № 1; Chemiluminescence in analytical chemistry / Ed. By Ana M. Garcia-Campaňa. — New York; Basel, 2001.
