ХЕМІЛЮМІНЕСЦЕНТНІ ІНДИКАТОРИ (хромофори) — сполуки певної будови, які здатні вступати в хімічні реакції з активними формами оксигену або органічними вільними радикалами тощо, а отже, утворювати молекули продуктів у збудженому електронному стані, що приводить до виникнення яскравої хемілюмінесценції (див. Хемілюмінесценція). Х.і. під час участі у хемілюмінесцентних реакціях піддаються незворотному окисненню і не регенеруються. Тому назва «Х.і.» є дещо умовною, відрізняється від назви «індикатор» у традиційному розумінні цього слова. Хемілюмінесцентні реакції індикаторів є окисно-відновними реакціями, механізм яких складний і для більшості систем дотепер залишається недостатньо вивченим.
Найпоширенішим представником Х.і. є люмінол — 5-аміно-1,2,3,4-тетрагідро-1,4-фталазиндіон або гідразид 3-амінофталевої кислоти (Н2L), Mr = 177,11 г/моль; жовті кристали; Тпл >300 °С; поганорозчинний у воді, добре — у лузі. Залежно від рН розчину може існувати у вигляді Н3L+ (pKa=1,3), Н2L (pKa=6,74) і НL— (pKa=14,2). У кислих та нейтральних середовищах при опроміненні УФ-світлом спостерігається флуоресценція (λзбуд = 350 нм, λмакс = 450 нм), у лужному середовищі в присутності окисників — блакитна хемілюмінесценція (λмакс = 425 нм) (рис. 1). Під дією окисника (в даному випадку радикала гідроксилу) відбувається утворення радикала люмінолу, який потім вступає в реакцію з надоксидним аніон-радикалом оксигену ·ОО—, утворючи внутрішній (трансануляний) пероксид (діоксид). Його розкладення призводить до утворення збудженої молекули 3-амінофталату. Перехід цієї молекули в основний стан супроводжується випромінюванням кванта світла.
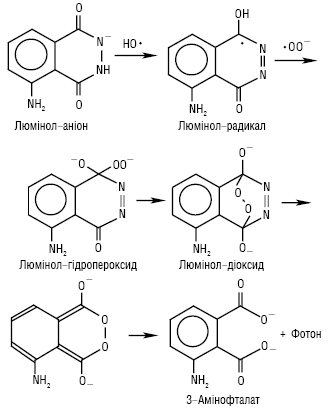
Рис. 1. Хемілюмінесцентне окиснення люмінолу
Одержують із 3-нітрофталевої кислоти. Люмінол — хемілюмінесцентний індикатор при кислотно-основному, окисно-відновному (броматометрія тощо) та комплексонометричному титруванні. Застосовують для хемілюмінесцентного визначення мікрокількостей Н2О2, активних форм оксигену (зокрема ·ОН, ·ОО—), К3[Fe(CN)6], S2O82-, ClO—, KMnO4, Cl2, Br2, гемоглобіну крові (див. ГЕМОТЕСТ-М), Сu (II), Co (II), Ni (II), Fe (III), Mn (II), Cr (III), Ag (I), Ti (IV), Zr (IV), Ce (IV), V (V), Sb (V), платинових металів, а також органічних сполук 8-оксихіноліну, фенілендіамінів, фенолів, катехоламінів, флавоноїдів, аскорбінової кислоти, похідних фосфонової та фосфатної кислот (пестициди, інсектициди, фосфоровмісні бойові хімічні отруйні речовини) з нижньою межею від 0,5 нг до 0,1 мкг до мл кінцевого об’єму.
Другим за значущістю серед хемілюмінесцентних індикаторів є люцигенін — динітрат 10,10'-диметил-9,9'-діакридинію (Lc), мол. м. 512,51 г/моль; золотисто-жовті кристали, Тпл 330 °С; добрерозчинний у воді, погано — в етанолі. У кислому та нейтральному середовищах при опроміненні УФ-світлом спостерігається зелена флуоресценція (λзбуд = 360 нм, λмакс = 510 нм). Добувають із 9-аміноакридину. У той час як люмінол випромінює світло в присутності багатьох окисників, зеленувато-блакитне світіння люцигеніну (λмакс = 479 нм) виникає лише в присутності гідроген пероксиду і/або ·ОО—. У лужному середовищі сильні відновники-нуклеофіли, такі як гідразин, диметилгідразин, аскорбінова кислота, цистеїн, N-ацетилцистеїн, солі Fe (II), S2-, SO32-, SnO22-, NH2OH, Cr (II) тощо, викликають яскраву хемілюмінесценцію в присутності в розчині оксигену повітря. За оптимальних умов цей процес є найбільш ефективним серед неферментних хемілюмінесцентних реакцій, відомих на сьогодні. Естери акридинію та нещодавно запропонований українськими вченими новий Х.і. — 9-ціано-10-метилакридинію нітрат (ЦМА) — також вступають у високоефективні реакції з Н2О2, даючи акридон (рис. 2, 3). В усіх вказаних реакціях утворюється проміжна сполука одного типу, а саме лабільний заміщений 1,2-діоксетан. Вилученню світла передує узгоджене розщеплення декількох спряжених подвійних зв’язків цього ключового інтермедіату, а потім відбувається утворення збуджених молекул N-метилакридону — емітера хемілюмінесценції (див. рис. 2).
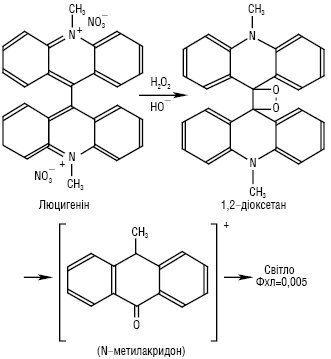
Рис. 2. Окиснення люцигеніну
Х.і. при кислотно-основному (рН 8,5–9), окисно-відновному та комплексонометричному титруванні; адсорбційний індикатор в аргентометрії. Реагент для хемілюмінесцентного визначення мікрокількостей Ag (I), Pb (II), Os (VIII), Th (IV), Mn (II), Bi (III), Cu (II), Ni (II), Fe (III), Cr (III), аскорбінової кислоти та інших відновників.
Х.і. можуть бути використані при багатьох РН та реакціях окиснення-відновлення. У випадку РН дія Х.і. ґрунтується на виникненні або зникненні окисно-відновної реакції, яка супроводжується хемілюмінесценцією при досягненні певного значення рН розчину в процесі титрування. Х.і. придатні для визначення вмісту кислот у темнозабарвлених винах, жирах та маслах, для аргентометричного визначення йодидів, для коплексонометричного визначення іонів купруму (ІІ) та інших металів, при хроматографічному визначенні іонів плюмбуму (ІV). Суміш люмінолу з флуоресцеїном у присутності гідроген пероксиду використовують для титрування слабких і сильних кислот та лугів за відсутності в них карбонатів. У реакціях люцигеніну з біологічними відновниками (аскорбінова кислота, глюкоза, фруктоза) та гідроген пероксидом, а також люмінолу з гідроген пероксидом уведення катіонних ПАР збільшує інтенсивність хемілюмінесценції на порядок.
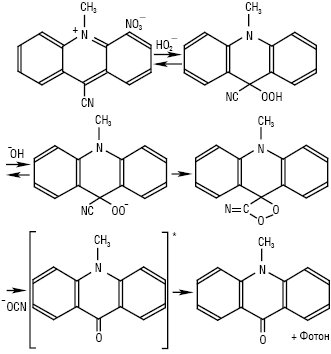
Рис. 3. Окиснення нітрату 9-ціано-10-метилакридинію
При окисненні Х.і. лофіну (2,4,5-трифенілімідазолу) і деяких сполук, близьких за структурою, в лужному середовищі оксигеном з’являється обумовлене хемілюмінесценцією зелене забарвлення реакційної суміші (рис. 4). Це явище вперше було описане у 1877 р. Механізм виникнення хемілюмінесценції включає три стадії: 1) атака оксигеном або гідроген пероксидом та утворення гідропероксиду; 2) перетворення на інтермедіат — діоксетан; 3) розривання пероксидного зв’язку, що супроводжується випромінюванням світла.
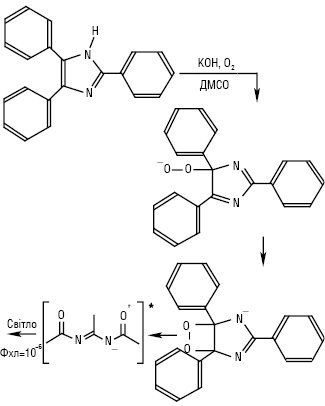
Рис. 4. Хемілюмінесцентне окиснення лофіну
Реагент для хемілюмінесцентного визначення Co (II), Cr (III), Сu (II), Fe (II) та інших іонів, а також таких катіонів, як гіпохлорит з Сmin ≅10–6 М. Як Х.і. в аналітичній хімії знайшов застосування силоксен, що являє собою золотисті листочки гексагональної форми. Особливістю силоксену є його здатність випромінювати світіння лише у дуже кислому середовищі. Силоксен добувають дією концентрованої хлороводневої кислоти на салідид кальцію. Найбільш імовірна структура силоксену:
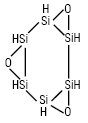
Відстані між атомами силіціуму у зв’язках Si-Si та Si-O однакові. Сильна хемілюмінесценція спостерігається в присутності сильних окисників — біхромату та перманганату, газоподібних NO, Cl2, Br2 у кислому середовищі, слабша — в присутності гідроген пероксиду, нітратної кислоти, солей Fe(III) тощо. При нагріванні інтенсивність хемілюмінесценції зростає. Перевагою силоксену як індикатора є те, що він реагує на надлишок окисника, не вимагає присутності каталізатора. Потенціал переходу індикатора +1,17 В.
Унаслідок пошуку Х.і., більш вибіркових, ніж люмінол, у 1977 р. запропоновано використовувати галову кислоту. При окисненні галової кислоти гідроген пероксидом у лужному середовищі спостерігається світіння у двох спектральних діапазонах — інтенсивна смуга при 643 нм і більш слабка при 478 нм. Цінною властивістю реакцій за участю цього індикатора є те, що на відміну від інших хемілюмінесцентних систем на випромінювання впливає дуже невелика кількість неорганічних речовин, хоча чутливість у цих випадках дещо нижча. Серед вивчених реакцій найвища чутливість досягається при визначенні Co(II): межа виявлення його 0,4 нг/мл, тоді як для Mg (ІІ), Ag (І), Cd (ІІ) та Pb (ІІ) Сmin знаходяться в інтервалі від 0,4 нг до 1 мкг/мл.
Бабко А.К., Дубовенко Л.І., Луковская Н.М. Хемилюминесцентный анализ. — К., 1966; Владимиров Ю.А. Активированная хемилюминесценция и биолюминесценция как инструмент в медико-биологических исследованиях // Соросовский образовательный журнал. — 2001. — Т. 7, № 1; Индикаторы / Под ред. Э. Бишопа. — Т. 2. — М., 1976; Chemiluminescence in analytical chemistry / Ed. By Ana M. Garcia-Campaňa. — New York; Basel, 2001.
