НІКОЛ (Niccolum < нім. Nickel < швед. Kopparnikel — гірський дух) (син.: Нікель) Ni — хімічний елемент VIII В групи періодичної системи Менделєєва, порядковий номер 28, ат. м. 58,71, Tпл — 1453 °С, Tкип — 3000 °С. Природний склад Н. — суміш 5 стабільних ізотопів: 58Ni (67,76%), 60Ni (26,16%), 61Ni (1,25%), 63Ni (3,66%), 64Ni (1,16%). Конфігурація зовнішніх електронів атома 3d84s2. Енергії іонізації (в еВ): Ni→Ni+→Ni2+→Ni3+ відповідно дорівнюють 7,633; 18,15; 35,16. Н. — ковкий та тягучий метал сріблясто-білого кольору, має 2 кристалічні модифікації: α 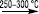 β з різними типами ґратки. Н., як і його аналоги Со та Fe, є феромагнетиком, але втрачає феромагнітні властивості при нагріванні (точка Кюрі — 358 °С). Феромагнетиками є й деякі його сполуки: NiO, NiS2 тощо. Вміст Н. у земній корі — 8·10–3%. Найбільш поширені мінерали — сульфідні мідно-нікелеві окиснені (силікатні) та арсенисті руди. Здебільшого Н. міститься в поліметалічних породах. 80% Н. одержують із сульфідних мідно-нікелевих руд. Це багатостадійний процес, який включає флотацію для виділення нікелевого концентрату, електричне плавлення з метою виділення сульфідного розчину, окиснення для усунення Fe, повторну флотацію для сепарації Cu та Н., випалювання у киплячому шарі для видалення S та отримання NiO. Металічний Н. одержують відновленням NiO в електричних дугових печах, а чистий Н. — електролітичним рафінуванням. Останнім часом широко застосовують карбонільний процес, що базується на легкості утворення Н. карбонільних комплексів за схемою:
β з різними типами ґратки. Н., як і його аналоги Со та Fe, є феромагнетиком, але втрачає феромагнітні властивості при нагріванні (точка Кюрі — 358 °С). Феромагнетиками є й деякі його сполуки: NiO, NiS2 тощо. Вміст Н. у земній корі — 8·10–3%. Найбільш поширені мінерали — сульфідні мідно-нікелеві окиснені (силікатні) та арсенисті руди. Здебільшого Н. міститься в поліметалічних породах. 80% Н. одержують із сульфідних мідно-нікелевих руд. Це багатостадійний процес, який включає флотацію для виділення нікелевого концентрату, електричне плавлення з метою виділення сульфідного розчину, окиснення для усунення Fe, повторну флотацію для сепарації Cu та Н., випалювання у киплячому шарі для видалення S та отримання NiO. Металічний Н. одержують відновленням NiO в електричних дугових печах, а чистий Н. — електролітичним рафінуванням. Останнім часом широко застосовують карбонільний процес, що базується на легкості утворення Н. карбонільних комплексів за схемою:
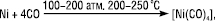 ,
,
які потім легко розкладаються (~200 °С та 1 атм.) з утворенням Н. високої чистоти (~9999). Хімічні властивості Н., з одного боку, схожі з Fe та Со, а з іншого — з Cu та благородними металами. Як і інші елементи VIIІ В групи, Н. має змінну валентність, особливо у своїх комплексних сполуках. У звичайних сполуках Н. здебільшого має валентність ІІ. За нормальних умов він стійкий до дії атмосферних газів, води, галогенів, халькогенів тощо, але при нагріванні активно з ними взаємодіє (окрім води) з утворенням сполук двовалентного Н. Дрібнокристалічний Н. пірофорний — самозаймається при контакті з повітрям. Через те, що Ni(OH)2 — слабка основа, розчини його солей мають кисле середовище. У низці напруг металів Н. знаходиться правіше за Fe, але розташований до Гідрогену, тому повільніше розчиняється у розведених кислотах. Цьому сприяє його анодна пасивація. Органічні кислоти діють на Н. тільки при тривалому контакті. У розведеній HNO3 Н. розчиняється легко, але концентрована кислота його пасивує. Луги на Н. не діють, але він легко розчиняється в надлишку аміаку з утворенням аміакатів синього кольору. Н., особливо у дрібнодисперсному стані, поглинає велику кількість газів, особливо водню. Певні хімічні сполуки при цьому не утворюються. Здатність Н. поглинати та активувати Гідроген дає можливість використовувати Н. як каталізатор у реакціях гідрогенізації та дегідрогенізації (Н. Ренея, каталізатор Бага — Егупова тощо). Сполуки тривалентного Н. виявляють сильні окисні властивості. У ході систематичного аналізу Н. визначають взаємодією з диметилгліоксимом — реактивом Чугаєва. У слабкокислому, нейтральному або аміачному середовищі розчин забарвлюється у червоний колір, а при надлишку реактиву випадає осад. Використовують також диціандіамідину сульфат — (C2H5N4O)2·H2SO4 (реактив Гросмана), який утворює з Н. в аміачному розчині осад жовтого кольору. Основна частка Н. використовується для одержання сплавів з іншими металами, які мають високі механічні, антикорозійні, термоелектричні властивості. Він використовується у хімічній та фармацевтичній промисловості для виготовлення спеціальної апаратури (напр. при виробництві флуору та його сполук, де Н. практично не кородує через утворення малорозчинної плівки NiF2 на поверхні) та як каталізатор багатьох хімічних процесів. Значна кількість Н. використовується для виробництва лужних акумуляторів. Спеціальні сталі з Н. використовують для виготовлення корозійностійкого медичного обладнання та інструментів.
Біологічна роль Н. ще мало вивчена, але він виявлений в усіх рослинних та тваринних організмах і практично не накопичується (крім легень). Цей біометал активує декілька ферментативних систем (ангідразу, карбоксилазу, трипсин та ін.). Він стимулює синтез амінокислот у клітині, а в невисоких концентраціях підвищує активність ферменту пепсину та покращує діяльність ферментів кровотворення, що нормалізує вміст гемоглобіну у крові, покращує генерацію білків плазми. При анемії його кількість у крові зменшується, а при гемолітичному захворюванні у дітей — різко зростає. Похідні Н. каталізують розщеплення сечовини на NH3 та CO2. У людей, які працюють зі сполуками Н., може виникнути професійне отруєння — нікелева екзема шкіри. Найбільший вміст Н. у печінці, нирках, підшлунковій залозі, легенях, плазмі крові. Як мікроелемент Н. входить до складу полівітамінних препаратів, таких, як Вітрум, Мега-Віте, Цевітам, Центрум тощо. Сполуки Н. виявляють протипухлинну, протимікробну, антибактеріальну, антивірусну, протизапальну та антисептичну, а також фунгіцидну дію. Солі Н. сприяють підвищенню врожайності рослин (особливо картоплі) та збільшенню вмісту алкалоїдів у ЛР (дурмані, беладоні).
Глазковский А.А. Никель. — М., 1963; Кольтгоф И.М., Сендэл Е.Б. Количественный анализ. — М., 1948; Краткая химическая энциклопедия. — М., 1988; Лазарева Н.В., Годаскина И.Д. Вредные вещества в промышленности. — Л., 1976; Суховєєв В.В., Сенченко Г.Г., Ковтун Г.О., Приплавко С.О. Металовмісні лікарські препарати. — К., 2000.
