НЕВОДНЕ ТИТРУВАННЯ — метод кислотно-основного титрування у неводних розчинниках, який застосовують для кількісного визначення кислот, основ та солей, якщо їх титрування у воді неможливе або утруднене за рахунок слабких кислотно-основних властивостей чи незначної розчинності.
Залежно від обраного розчинника речовина може змінювати свої кислотно-основні властивості, тобто бути кислотою, основою або не виявляти кислотно-основних властивостей. Вибір розчинника здійснюють з урахуванням величини константи титрування (Кт) або її логарифма (pКт). Чим менше значення Кт або чим більше значення pКт відповідно, тим кращі умови титрування. Кт розраховують за значеннями констант дисоціації розчиненої речовини (КА — для кислот; КВ — для основ) та константою автопротолізу розчинника (Кi), зокрема: для індивідуальних кислот 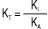 ;
; 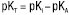 ; для індивідуальних основ
; для індивідуальних основ 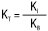 ;
; 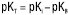 ;
; 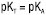 ; для сумішей двох кислот
; для сумішей двох кислот 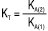 ;
; 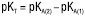 ; для сумішей двох основ
; для сумішей двох основ 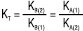 ;
; 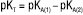 ; де 1, 2 — індекси, що позначають порядок нейтралізації. Неводні розчинники диференційовано впливають на силу кислот та основ. Згідно з класифікацією неводних розчинників за їх кислотно-основними властивостями розрізняють розчинники протолітичні, зокрема протогенні, які проявляють кислотні властивості, протофільні, які проявляють основні властивості, та амфіпротні, а також апротонні розчинники, що не мають виражених кислотно-основних властивостей. Розрізняють також диференціюючі розчинники, в розчинах яких проявляється значна різниця в силі кислот або основ. Оптимальні умови титрування слабких кислот (карбонові кислоти, феноли, барбітурати, сульфаміди, амінокислоти тощо) досягаються в основних розчинниках (піридині, ДМФА). Оптимальні умови титрування слабких основ (амінів, азотовмісних гетероциклічних сполук, амідів, четвертинних амонієвих основ тощо) досягаються у кислих розчинниках (в оцтовій кислоті, оцтовому ангідриді). Для роздільного титрування сумішей кислот або основ використовують диференціюючі розчинники (розчинники з pКi >15, що не мають виражених кислотно-основних властивостей), напр. кетони, нітрили, нітрометан. Солі деяких органічних і мінеральних кислот можуть бути відтитровані як основи в кислих розчинниках. Як титранти в кислих розчинниках використовують 0,1 М розчин HClO4 в оцтовій кислоті або нітрометані. Індикаторами при цьому є кристалічний фіолетовий, судан ІІІ, тропеолін 00; в основних розчинниках — 0,1 М розчини NaOH, KOH, NaOCH3; LiOCH3 у метанолі або в суміші метанолу і бензолу; індикаторами при цьому служать тимоловий синій, бромтимоловий синій тощо; у диференціюючих розчинниках — 0,1 М HCl у метанолі або гліколевих сумішах, 0,1 М HClO4 у нітрометані, етанолі, а також розчини, що застосовуються при титруванні в основних розчинниках; індикаторами при цьому є метиловий оранжевий, тимоловий синій, нейтральний червоний тощо. Н.т. може бути проведене як з індикаторами, так і потенціометрично з використанням електродної пари — скляного як індикаторного та хлорсрібного як електрода порівняння. При титруванні в основних розчинниках необхідно вживати заходів для захисту титранту і розчину від СО2 повітря, для чого титрування краще проводити в атмосфері інертного газу (азоту, гелію). При титруванні солей галогенводневих кислот у розчин додають розчин Hg(CH3COO)2 для зв’язування галогенідів. Кислотно-основне Н.т. значно розширює межі аналітичних визначень порівняно з водними розчинниками.
; де 1, 2 — індекси, що позначають порядок нейтралізації. Неводні розчинники диференційовано впливають на силу кислот та основ. Згідно з класифікацією неводних розчинників за їх кислотно-основними властивостями розрізняють розчинники протолітичні, зокрема протогенні, які проявляють кислотні властивості, протофільні, які проявляють основні властивості, та амфіпротні, а також апротонні розчинники, що не мають виражених кислотно-основних властивостей. Розрізняють також диференціюючі розчинники, в розчинах яких проявляється значна різниця в силі кислот або основ. Оптимальні умови титрування слабких кислот (карбонові кислоти, феноли, барбітурати, сульфаміди, амінокислоти тощо) досягаються в основних розчинниках (піридині, ДМФА). Оптимальні умови титрування слабких основ (амінів, азотовмісних гетероциклічних сполук, амідів, четвертинних амонієвих основ тощо) досягаються у кислих розчинниках (в оцтовій кислоті, оцтовому ангідриді). Для роздільного титрування сумішей кислот або основ використовують диференціюючі розчинники (розчинники з pКi >15, що не мають виражених кислотно-основних властивостей), напр. кетони, нітрили, нітрометан. Солі деяких органічних і мінеральних кислот можуть бути відтитровані як основи в кислих розчинниках. Як титранти в кислих розчинниках використовують 0,1 М розчин HClO4 в оцтовій кислоті або нітрометані. Індикаторами при цьому є кристалічний фіолетовий, судан ІІІ, тропеолін 00; в основних розчинниках — 0,1 М розчини NaOH, KOH, NaOCH3; LiOCH3 у метанолі або в суміші метанолу і бензолу; індикаторами при цьому служать тимоловий синій, бромтимоловий синій тощо; у диференціюючих розчинниках — 0,1 М HCl у метанолі або гліколевих сумішах, 0,1 М HClO4 у нітрометані, етанолі, а також розчини, що застосовуються при титруванні в основних розчинниках; індикаторами при цьому є метиловий оранжевий, тимоловий синій, нейтральний червоний тощо. Н.т. може бути проведене як з індикаторами, так і потенціометрично з використанням електродної пари — скляного як індикаторного та хлорсрібного як електрода порівняння. При титруванні в основних розчинниках необхідно вживати заходів для захисту титранту і розчину від СО2 повітря, для чого титрування краще проводити в атмосфері інертного газу (азоту, гелію). При титруванні солей галогенводневих кислот у розчин додають розчин Hg(CH3COO)2 для зв’язування галогенідів. Кислотно-основне Н.т. значно розширює межі аналітичних визначень порівняно з водними розчинниками.
Аналітична хімія / В.В. Болотов, О.М. Свєчнікова, С.В. Колісник та ін. — Х., 2004; ДФУ. — Х., 2001.
