НАДКИСЛОТИ, або ацилгідропероксиди (пероксикислоти, застаріле — перкислоти, англ. peroxy acids) — продукти заміщення одного атома Гідрогену в молекулі гідроген пероксиду на ацильну групу загальної формули: RC(O)OOH (мононадкислоти), HOO(O)C(CH2)nС(О)ООН (динадкислоти або динаддикислоти), а також HOO(O)C(CH2)nС(О)ОН (мононаддикислоти), де R=Alk, Ar. При R=С1–С6 — рідини; перші три члени ряду розчинні у воді; вибуховонебезпечні. Властивості мононадкислот з С <6 (див. Кислота надацетатна). Аліфатичні надкислоти С6–С18 — тверді кристалічні білого кольору не розчинні у воді при кімнатній температурі сполуки за винятком надгексанової кислоти, яка слабо розчинна у воді з Tпл 15 °С. Ці Н. розчинні в бензолі, гексані, кетонах, естерах і етерах. Відомі аліфатичні мононаддикислоти С4– С5 — тверді кристалічні білого кольору розчинні у воді сполуки. Аліфатичні динаддикислоти С4–С16 — тверді кристалічні сполуки білого кольору, С4–С7 — розчинні у воді, С5–С16 — розчинні в етанолі, ацетоні, етері та діоксані і не розчинні у вуглеводнях; С8–С16 — при кімнатній температурі надзвичайно стабільні і не чутливі до удару. Фізико-хімічні характеристики деяких Н. наведені в таблиці. Наявність внутрішнього молекулярного водневого зв’язку та знижена резонансна стабілізація аніона призводять до зниження кислотності Н. порівняно з відповідними їм карбоновими кислотами на 3,5 порядку, а асиметрія зв’язку О−О групи зумовлює їх виражену оксидаційну властивість; термодинамічно нестійкі (особливо нижчі члени гомологічного ряду): зазнають самовільного розкладення як у рідкому, так і у твердому станах, а також у водних розчинах переважно за гетеролітичним іон-молекулярним механізмом з утворенням відповідної материнської кислоти та оксигену (рис. 1), а також за каталізованими кислотами або лугами реакціями гідролізу (рис. 2), а відтак пергідролізу (взаємодія з утвореним або наявним у розчині гідроген пероксидом) та у середовищах органічних розчинників або шляхом декарбоксилювання, розкладаються при контакті з перехідними металами і при нагріванні; окиснюють сульфіди та третинні аміни у S-оксиди і/або сульфони та N-оксиди відповідно, тіоли і дисульфіди — до тіолсульфінатів, а потім у відповідні тіолсульфонати; первинні ариламіни залежно від будови та умов — ступенево у нітрозо- або азо-, азоксі-, а відтак — нітропохідні; утворюють епоксиди з олефінами та естери з кетонами. Стійкість Н. зростає з видовженням їх вуглеводневого радикала. Застосування Н. як окисників засноване на реакції їх відновлення до материнської кислоти і води:
RCO3H + 2H+ + 2e = RCO2H + H2O,
де R=СН3.
Реальний оксидаційний потенціал системи надкислота–карбонова кислота ϕ0=1,55–1,6 В (0,1 М НCl, I=0,02 M). Характерною особливістю розчинів Н. є відсутність впливу відповідних кислот — продуктів їх термолізу — на величину ϕ. Залежність оксидаційного потенціалу системи RCO3H/RCO2H,H2O від рН за умов рівності активностей (або концентрацій при I=0) має вигляд:
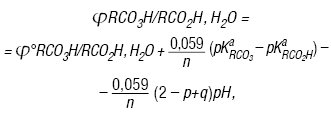
де: та — константи дисоціації Н. та кислоти відповідно; Т = 298 К; n = 2; p і q — функції утворення Б’єрума, які дорівнюють:
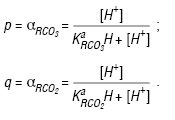
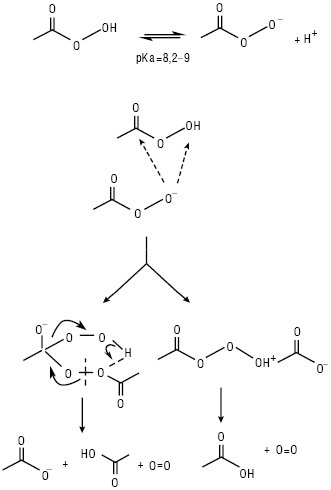
Рис. 1. Механізми розкладення Н. у водних розчинах
Із видовженням вуглеводневого радикала оксидаційний потенціал Н. зростає пропорційно різниці величин pKa Н. та відповідної їй кислоти. На кривих ϕ — рН спостерігаються згини при значеннях рН рКа (у випадку динадкислот — (рКa1 + рКa2)/2). ІЧ- спектрам Н. притаманні характерні смуги при 855–875 см-1 (валентні коливання групи О–О, слабке поглинання), 3200–3280 см-1 (валентні коливання O–H, зв’язаної наявним внутрішньомолекулярним водневим зв’язком), 1430–1450 см-1 (деформаційні коливання δO–H), для групи С=О поглинання на ділянці 1740–1760 см-1. Пероксидна група слабко поглинає на ділянці 250–320 нм. У спектрах комбінаційного розсіювання найінтенсивніша смуга при 865 см-1, яка належить валентним коливанням групи О−О. Потенціали півхвиль відновлення Н. на ртутному електроді становлять 0,1 В (стосовно нормального каломельного електрода). Способи добування: автоокиснення альдегідів, ацилювання гідроген пероксиду відповідними кислотами в присутності кислотних каталізаторів (напр. класичний сульфатнокислотний метод Крима) або ангідридами чи хлорангідридами в умовах реакції Шотена — Баумана, пергідроліз ацилпероксидів.
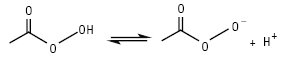
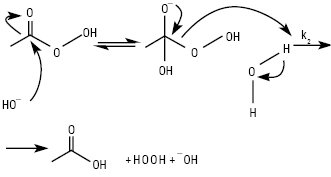
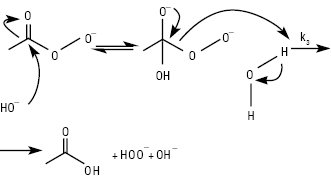
Рис. 2. Механізм лужного гідролізу Н.
Таблиця. Фізико-хімічні характеристики деяких надкислот
| Н. (назва-синонім), хімічна формула | ТПЛ, °С | ОАКТ, % | Мол. м., г/моль |
рКa (рКa1; рКa2 — для Н.) |
| Надоктанова (пероксикаприлова), H3C-(СH2)6CO3H Наднонанова (пероксипеларгонова), H3C-(СH2)7CO3H Наддеканова (пероксикапринова), H3C-(СH2)8CO3H Надундеканова (пероксіундеканова), H3C-(СH2)9CO3H Наддодеканова (пероксилауринова), H3C-(СH2)10CO3H Динадпентандіова (дипероксиглутарова), HO3C(СH2)3CO3H Динадгександіова (дипероксіадипінова), HO3C(СH2)4CO3H Динаднонандіова (дипероксіазелаїнова), HO3C(СH2)7CO3H Динаддекандіова (дипероксисебацинова), HO3C(СH2)8CO3H Мононадбутандіова (монопероксибурштинова, монопероксисукцинатна), HO2C(СH2)2CO3H |
31–31,5 (розкл.) 35–35,5 (розкл.) 41–41,5 (розкл.) 47,5–48 (розкл.) 52 (розкл.) 91–91,5 (розкл.) 114,5 (розкл.) 90–90,5 (розкл.) 96 (розкл.) 107 (розкл.) |
9,98 9,18 8,5 6,95 7,40 19,5 17,9 14,5 13,7 11,9 |
160,2 174,2 188,3 202,3 216,3 164,1 178,2 220,2 234,1 134,1 |
8,2 8,3 8,5 8,7 8,9 7,55; 8,41 7,56; 8,68 8,08; 9,19 7,68; 8,35 6,21; 8,73 |
Н. застосовують у препаративному синтезі та промисловій практиці (зокрема у фармацевтичній) як вибіркові (стереоселективні) окисники для одержання сульфоксидів (енантіомерів), тіолсульфінових кислот з тіоловмісних сполук і дисульфідів, аміноксидів (напр. алкалоїдів кодеїну, стрихніну, діоніну, хініну тощо), оксиранів і т.д. Їх застосовують у процесі одержання антибіотиків цефалоспоринового ряду, діоксидину, S-оксидів та сульфонів фентіазинів тощо, для стерилізації і дезінфекції реакторів. У медицині, народному і сільському господарстві, а саме цукровій, пивоварній, харчовій промисловості, Н. широко застосовують як бактерициди та спороциди (а також як відбілювачі) у складі відомих дезінфекційних, стерилізуючих і/або мийних засобів (напр. у препаратах Делаксон (Україна), Steridial (Польща), Дезоксон-1 (Росія), Persil (США) (див. Кислота надацетатна, Первомур, Кислота надбензойна). Бактерицидна та спороцидна активність Н. знаходиться в симбатній залежності від їх оксидаційної здатності. Для препаративного одержання сульфоксидів фентіазинів (речовини, які мають сперматоцидну дію) як окисник запропонована динададипінова кислота. Надацетатну, наддеканову, динададипінову, динадазелаїнову та динадсебацинову кислоти використовують як аналітичні реагенти, а надацетатну і динадбурштинову — як проміжні аналітичні форми у фармацевтичному аналізі. Напр., кількісне визначення дипразину (прометазину) у розчині для вживання per os Фармакопея Великобританії (1993 р.) пропонує виконувати методом спектрофотометрії у вигляді відповідного S-оксиду, який одержують за допомогою виготовленим in situ розчином надацетатної, а вибіркове визначення ацетилсаліцилової кислоти в таблетках і суксаметонію йодиду в препараті дитилін виконують за їх продуктами пергідролізу — надацетатною і надбурштиновою кислотами відповідно. Аліфатичні надкислоти застосовують як реагенти в кінетичних методах визначення перехідних металів та деяких органічних сполук (див. Кінетичні методи аналізу). Запропоновано використовувати утворення Н. як проміжних аналітичних форм для якісного визначення естерів. Запатентовані оригінальні стерилізуючі та дезінфікуючі композиції, до складу яких входять вищі моно- та динадкарбонові кислоти, призначені для застосування в медицині, народному та сільському господарстві, а також у військовій справі як знешкоджувачі біологічної та хімічної зброї, а також для дезінфекції питної води. Вони характеризуються високою ефективністю, універсальністю стосовно сфер застосування і достатньою стабільністю. Розбавлені до ефективних концентрацій для дезінфекції і стерилізації Н. не є вибухонебезпечними і не виявляють токсичності для ссавців. Однак у концентрованих розчинах із ними необхідно поводитися із застереженням як із сильними окисниками. Їх необхідно зберігати в холодному місці при температурі нижче +30 °С. Слід уникати контакту з органічними матеріалами та іонами важких металів, особливо Купруму, Феруму та Мангану, оскільки вони можуть швидко розкладатися і призводити до вибуху, а також пожежі. При роботі з концентрованими Н. необхідно користуватися латексними рукавичками, захисними окулярами, бути одягненим у захисний костюм. У разі попадання Н. на шкіру або слизові оболонки змивати великою кількістю води. Слід давати пити молоко.
Антоновский В.Л., Бузланова М.М. Аналитическая химия органических пероксидных соединений. — М., 1978; Большой энциклопедический словарь. Химия / Гл. ред. И.Л. Кнунянц. — М., 1998; Дрюк В.Г., Карцев В.Г., Войцеховская М.А. Оксираны — синтез и биологическая активность. Механизм, ассоциативные и стерические эффекты пероксидного эпоксидирования алкенов. — М., 1999; Красильников А.П. Справочник по антисептике. — Минск, 1995; Ind. Biocides/ Ed. K.R. Payne. — New York, 1988; Organic peroxides / Ed. D. Swern. — New York, 1970.
