РАУЛЯ ЗАКОН: тиск насиченої пари даного компонента розчину, тобто парціальний тиск пари компонента, дорівнює тиску насиченої пари цієї речовини у вільному стані, помноженому на її мольну частку в розчині xі:
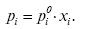 (1)
(1)
Для розчинника можна записати
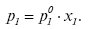 (2)
(2)
Оскільки у бінарному розчині х1 = 1 — х2, то
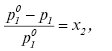 (3)
(3)
тобто відносне зниження тиску насиченої пари розчинника над розведеним бінарним розчином не залежить від природи розчиненої речовини і дорівнює її мольній частці х2.
Якщо другий компонент — нелетка речовина, то p1 є одночасно і загальним тиском насиченої пари над розчином Pзаг. Розчини, які підпорядковуються Р.з., називаються ідеальними.
Із рівняння (1) випливає, що при будь-якій температурі p1 < p01 і температурна крива залежності тиску пари розчинника над розчином 2 розташовується нижче кривої тиску пари чистого розчинника 1 (рис. 1). Тобто при будь-якому зовнішньому тиску Рзовн температура кипіння розчину Tкип, який містить нелеткі розчинені речовини, вища за температуру кипіння розчинника Tкип0. Для достатньо розбавлених розчинів можна прийняти, що підвищення температури кипіння ∆Tкип пропорційне моляльній концентрації розчину т
∆Tкип = E·m, (4)
де Е — ебуліоскопічна стала розчинника.
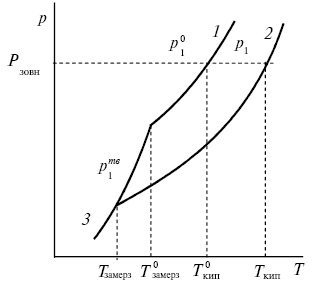
Рис. 1. Підвищення температури кипіння і зниження температури замерзання розбавлених розчинів
Якщо при затвердінні розбавленого розчину нелеткої розчиненої речовини виділяються кристали розчинника, то при температурі початку кристалізації лінія тиску розчину 2 повинна перетинати лінію тиску пари твердого розчинника 3 (див. рис. 1). Із рис. 1 видно, що температура початку замерзання розчину Tзамерз буде нижчою, ніж температура замерзання розчинника Tзамерз0. Для достатньо розбавлених розчинів можна прийняти, що зниження температури замерзання ∆Tзамерз пропорційне моляльній концентрації розчину т
∆Tзамерз = K·m, (5)
де K — кріоскопічна стала розчинника.
Ебуліоскопічний та кріоскопічний методи дослідження, що ґрунтуються відповідно на вимірюванні підвищення Tкип і зниженні Tзамерз розбавлених розчинів нелетких розчинених речовин, знайшли застосування у фармацевтичній практиці (див. Кріоскопія та Ебуліоскопія).
Розчини, які не підпорядковуються Р.з., називаються реальними. Якщо парціальні тиски компонентів вищі за значення, розраховані за Р.з., то говорять про позитивні відхилення від ідеальності, якщо нижчі — про негативні відхилення, напр. для сумішей органічних речовин типу C6H6-(CH3)2CO, (C2H5)2O-CHCl3 (рис. 2).
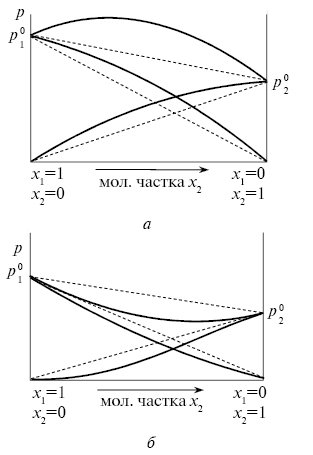
Рис. 2. Позитивні (а) й негативні (б) відхилення від ідеальності. Пунктиром указані відповідні залежності для ідеальних розчинів
Для реальних розчинів наведені рівняння Р.з. будуть справедливими при заміні концентрації певною її функцією, яка називається термодинамічною активністю або просто активністю відповідного компонента ai. Напр., рівняння (1) набуває вигляду
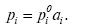 (6)
(6)
Вираз (6) називають узагальненим рівнянням Р.з. і може бути застосованим як для ідеальних, так і для реальних розчинів. Величина активності залежить від природи і концентрації всіх компонентів розчину, а також від тиску і температури. Розв’язавши рівняння (6), відносно аі маємо
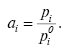 (7)
(7)
Із виразу (7) випливає, що, по-перше, аі — безрозмірна величина і, по-друге, є відносною активністю, тому що виражена через відношення тиску пари компонента у даному розчині до тиску пари компонента у чистому стані. Такий стан можна вважати стандартним, по відношенню до нього визначається активність і де вона дорівнює одиниці. Такий підхід використовують при вивченні властивостей розчинів неелектролітів.
І.В. Красовським і Л.Д. Грицан було показано, що активність кожного компонента розчину може бути розрахована за допомогою будь-якої інтенсивної властивості розчину за рівнянням:
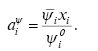 (8)
(8)
Верхній індекс при аі указує, до якої властивості належить дана активність; 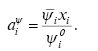 — величина властивості чистої і-тої речовини;
— величина властивості чистої і-тої речовини; 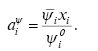 — диференціальна молярна величина властивості компонента і, яка визначається експериментально; xi — мольна частка речовини у розчині.
— диференціальна молярна величина властивості компонента і, яка визначається експериментально; xi — мольна частка речовини у розчині.
Використання «активності за властивістю» дозволяє знаходити цю величину за допомогою властивостей розчину, які вимірюються достатньо легко і точно (показник заломлення, густина тощо).
Коробов М.В. Рауля закон. В кн.: Химическая энциклопедия: В 5 т. — М., 1995. — Т. 4; Красовский И.В., Вайль Е.И., Безуглый В.Д. Физическая и коллоидная химия. — К., 1983; Красовский И.В., Грицан Л.Д. Определение активностей с помощью различных свойств растворов // Журн. физ. химии. — 1976. — Т. 50; Лебідь В.І. Фізична хімія. — Х., 2008.
