Протромбіновий час характеризує першу (протромбіноутворення) і другу (тромбіноутворення) фази плазмового гемостазу і відбиває активність протромбінового комплексу (факторів VII, V, X і власне протромбіну — фактора II), (для дорослих у нормі 11–15 с, для немовлят — 13–18 с). Збільшення П.ч. свідчить про схильність до гіпокоагуляції і може залежати від різних причин: недостатності одного чи декількох факторів протромбінового комплексу при таких рідкісних спадкових коагулопатіях, як гіпопроконвертинемія (дефіцит фактора VII) і гіпопротромбінемія (дефіцит фактора II); при амілоїдозі відмічають збільшення П.ч., пов’язане з дефіцитом фактора X, що поглинається амілоїдом, а при нефротичному синдромі — з дефіцитом факторів VII і V, що виділяються із сечею, синтезу факторів протромбінового комплексу в клітинах печінки, при захворюваннях якої їх кількість зменшується, і П.ч. певною мірою може служити показником функціонального стану печінки. Збільшення П.ч. відзначається при гострих гепатитах, хронічних гепатитах, цирозах печінки, підгострій дистрофії печінки та інших ураженях паренхіми печінки і є недоброю прогностичною ознакою. При цьому причиною збільшення П.ч. може стати порушення всмоктування вітаміну К, що розвивається внаслідок зменшення надходження жовчі в кишечник, необхідного для синтезу факторів протромбінового комплексу. Така ж причина збільшення П.ч. і при механічній жовтяниці; ентеропатія й кишкові дисбактеріози, що призводять до недостатності вітаміну К, також можуть супроводжуватися збільшенням П.ч.; при лікуванні антагоністами вітаміну К — антикоагулянтами непрямої дії — порушується кінцевий етап синтезу факторів протромбінового комплексу, і П.ч. подовжується. Терапія непрямими антикоагулянтами вважається адекватною, якщо П.ч. збільшується приблизно в 2 рази; витрачання факторів протромбінового комплексу при гострому ДВЗ-синдромі призводить до досить раннього збільшення П.ч. (у 2 рази і більше); при хронічному панкреатиті, раку підшлункової залози та жовчного міхура збільшення П.ч. може бути результатом ураження печінки і (чи) розвитку ДВЗ-синдрому; афібриногенемія, гіпофібриногенемія (зниження вмісту фібриногену в крові до 1 г/л і нижче), а також надлишковий вміст гепарину в крові ведуть до збільшення П.ч.; подовження П.ч. виявляється при гострих і хронічних лейкозах унаслідок розвитку ДВЗ-синдрому; підвищення рівня антитромбіну або антитромбопластину в крові також призводить до подовження П.ч.; ціла група ЛП здатна подовжувати П.ч.: ацетогексамід, анаболічні стероїди, антибіотики, ацетилсаліцилова кислота (у високих дозах), проносні засоби, метотрексат, нікотинова кислота, хінідин, хінін, тіазидні діуретики, толбутамід. Зменшення П.ч. свідчить про схильність до гіперкоагуляції і може виявлятися на початкових стадіях тромбозу глибоких вен нижніх кінцівок, при поліцитемії, в останні місяці вагітності. Зменшення П.ч. може спричинити вживання таких ЛП: ацетилсаліцилова кислота (у невисоких дозах), меркаптопурин, пероральні контрацептиви. Визначення П.ч. відіграє провідну роль у контролі за пероральною антикоагулянтною терапією. Однак при такому контролі П.ч. залежить від чутливості тромбопластину, який використовується. Тому порівняння результатів досліджень з використанням різних тромбопластинів є важливим завданням практичної медицини. Різні тромбопластини розрізняють за ISI (International Sensitivity Index — Міжнародний індекс чутливості), що додається до опису кожного набору. У 1983 р. ВООЗ разом з Міжнародним товариством тромбозу і гемостазу ухвалили тромбопластин з мозку людини як референтний і установили, що ISI цього тромбопластину дорівнює 1,0 (Міжнародний референтний препарат ВООЗ). Усі інші комерційні тромбопластини калібруются за ним, і для кожного визначається своя чутливість (ISI). Для порівняння результатів дослідження П.ч. у хворих, що одержують пероральну антикоагулянтну терапію, необхідно розрахувати INK (International Normalized Ratio), або Міжнародне нормалізоване відношення (MHO):
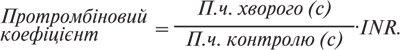
INR — це спроба математично скоригувати різницю, яку дають тромбопластини з різною чутливістю, тобто привести результат до даних, отриманих з референтним тромбопластином (табл. 1).
Таблиця 1. Нормалізація протромбінового часу при використанні 4 різних тромбопластинів з розрахунку INR
| Тромбопластин ISI | П.ч., с | Розраховані величини |
||
| Пацієнт | Контроль | PTR | INR | |
| 1,2 | 24 | 11 | 2,2 | 2,6 |
| 3,2 | 16 | 12 | 1,3 | 2,6 |
| 2,0 | 21 | 13 | 1,6 | 2,6 |
| 1,0 | 38 | 14,5 | 2,6 | 2,6 |
Лабораторіям рекомендовано працювати з тромбопластином, що має ISI менше 1,5. Кролячі тромбопластини мають ISI=2,0–3,0. У США всі лабораторії перейшли на плацентарний людський тромбопластин з ISI=1,0.
Основне завдання моніторингу застосування пероральних антикоагулянтів — це запобігання кровотечі. До останнього часу рекомендували підтримувати П.ч. при лікуванні непрямими антикоагулянтами в 2–2,5 раза довше норми (кролячий тромбопластин). Однак цей час виявився занадто великим, що часто призводило до кровотеч. На сьогодні відмічають тенденцію до переходу на більш короткий час. ВООЗ розроблено рекомендації для контролю рівня антикоагулянтів — виражені в INR (табл. 2).
Таблиця 2. Рівень антикоагулянтів, рекомендовані рівні, в INR
| Клінічний стан | Рекомендований INR |
| Профілактика тромбозу глибоких вен | 2,0–3,0 |
| Лікування тромбозу глибоких вен і легеневої тромбоемболії | 2,0–3,0 |
| Рецидований тромбоз глибоких вен, легенева тромбоемболія | 2,0–3,0 |
| Протези клапанів з власної тканини | 2,0–3,0 |
| Механічні протези клапанів серця | 2,5–3,5 |
Для зручності розрахунків INR наводимо шкалу, на якій показано залежність INR від ISI та PTR (див. табл. 1). На вертикальній шкалі ліворуч наведено величини PTR (відношення П.ч. пацієнта до П.ч. контрольної плазми крові), а на горизонтальній шкалі вгорі — значення ISI (для різних тромбопластинів). На перетині ліній цих двох параметрів знаходиться INR для цього пацієнта.
Фактор VII (проконвертин). Активність фактора VII у плазмі крові в нормі — 65–135%. Фактор VII (проконвертин або конвертин) належить до α-2-глобулінів і синтезується в печінці за участю вітаміну К. В основному бере участь в утворенні тканинної протромбінази і перетворенні протромбіну в тромбін. Період його напіврозпаду становить 4–6 год (найкоротший період напіврозпаду у факторів згортання). Уроджена нестача фактора VII зумовлює розвиток геморагічного діатезу (хвороба Александера). Набуті форми гіпопроконвертинемії зустрічаються у немовлят у перші дні життя, у хворих з ураженням печінки, а також унаслідок дії непрямих антикоагулянтів. Відзначається зниження активності проконвертину в плазмі крові у хворих на вірусні гепатити, цирози печінки, при гострому алкогольному гепатиті, хронічному персистувальному гепатиті. У хворих на цирози печінки спостерігається чіткий зв’язок між зниженням рівня проконвертину і тяжкістю перебігу процесу. Через короткий період напіврозпаду зниження активності проконвертину є кращим маркером розвитку печінкової недостатності. Мінімальний гемостатичний рівень активності фактора VII у крові для виконання операцій становить 10–20%, при більш низькому вмісті ризик розвитку післяопераційних кровотеч надзвичайно високий. Мінімальний гемостатичний рівень активності фактора VII у крові для зупинки — 5–10%, при більш низькому вмісті зупинка кровотечі без уведення хворому фактора VII неможлива, при ДВЗ-синдромі, починаючи з II стадії, знижується активність фактора VII унаслідок коагулопатії витрачання.
Бышевский А.Ш., Терсенов О.Л. Биохимия для врача. — Екатеринбург, 1994; Иньков А.Н. О чем говорят анализы? — Ростов-на-Дону, 2000; Козинец Г.И. Интерпретация анализов крови и мочи. — М., 1998; Лабораторные методы исследования в клинике / В.В. Меньшиков, Л.Н. Делекторская, Р.П. Золотницкая и др. — М., 1997; Цынко Т.Ф. Диагностика заболеваний по анализам крови и мочи. — Ростов-на-Дону, 2004.
