КУЛОНОМЕТРІЯ — електрохімічний метод кількісного аналізу, що базується на вимірюванні кількості електричного струму, витраченого на електрохімічне окиснення чи відновлення іонів або елементів, що визначають, у процесі електролізу. В основу методу покладено закон Фарадея:

де m — маса іона або елемента, що визначають, г; F — число Фарадея 96 500 К; А — атомна маса елемента; n — кількість електронів, що беруть участь в електрохімічному окисненні-відновленні; І — сила електричного струму, А; t — час електролізу, с; Q — кількість електрики, К.
При проведенні кулонометричних визначень необхідно створити такі умови електролізу, щоб електричний струм витрачався лише на основну електрохімічну реакцію і були виключені побічні процеси, для чого пильно контролюють зовнішню напругу, яка забезпечує тільки електроліз речовини, що визначається, але недостатня для виникнення побічних електрохімічних реакцій (ретельно запобігають електрохімічному розкладу води). Момент кількісного завершення електрохімічної реакції встановлюють за допомогою окисно-відновних індикаторів (фенілантранілова кислота та ін.); потенціометричним (індикаторний електрод — платиновий) та амперометричним методами. За типом реакції кулонометричні методи аналізу поділяють на: 1) відновлення іонів металів та виділення їх у вільному стані: Men+ + nē Me0 (Cu2+, Pb2+, Bi3+, Cd2+ та ін.); у цьому разі використовують ртутний катод; 2) анодне окиснення металів, добутих електролізом з розчину, що аналізують, — вимірювання кількості електрики, витраченої на анодне розчинення металів: Me Men++nē (визначення аргентуму та деяких важких металів у кількості 10–8–10–10 г); 3) електролітичне окиснення чи відновлення іонів у розчині: Men+ + аē Men-a (визначення феруму Fe2+ → Fe3+, арсену As+3 → As+5). У зазначених випадках електричний струм витрачається тільки на окиснення або відновлення іонів.
При кулонометричному титруванні паралельно з електрохімічною реакцією, що перебігає під дією електричного струму, здійснюється хімічна реакція між речовиною, що визначається, та продуктом електрохімічної реакції. Струм витрачається на окиснення-відновлення допоміжних іонів, які додають до розчину в надлишку. Кулонометричне титрування дає змогу усунути побічні реакції (електроліз води). Перевагою кулонометричного титрування є відсутність титрованих розчинів: титрування окисників (хрому, мангану, ванадію та ін. на вищому ступені окиснення) здійснюють генерованими іонами Ti3+, Sn2+, Cu2+; титрування відновників (As(III); Sb(III), Fe(II)) — за допомогою генерованого брому або йоду.
Для обчислення результатів кулонометричних визначень вимірюють кількість електрики Q, витраченої на електрохімічну реакцію, за допомогою кулонометрів (хімічних інтеграторів) — електролітичних комірок, в яких при замкненні ланцюга з 100% виходом по струму перебігає електрохімічна реакція відомої стехіометрії. Найбільш точними в роботі є срібний та мідний кулонометри. Представником газових кулонометрів є воднево-кисневий кулонометр, в якому під дією електричного струму відбувається електроліз води з утворенням газової суміші гідрогену та оксигену: на катоді Н2О+ē → ½ Н2+ОН—; на аноді Н2О—2ē → ½О2+2Н+. Об’єм суміші газів пропорційний кількості електрики, витраченої на електроліз, вимірюють каліброваною бюреткою. До титраційних кулонометрів належить ванадієвий, дія якого базується на окисненні ванадил-іона в розчині його сульфатнокислої солі: +ē+O2++2H2O  VO3— +4H+. Кількість VO3– визначають при титруванні розчином FeSO4 (індикатор — фенілантранілова кислота). Хронометричним методом (К. при постійній силі струму) проводять визначення Q при незмінній силі струму протягом всього електролізу, час якого визначають секундоміром: Q = І·t, де І — сила електричного струму, А; t — час електролізу, с. Постійна сила струму забезпечується послідовним підключенням у ланцюг високоомного опору (10–25 тис. Ом), напруга — 100–200 В. Хронометричний метод визначення кількості електрики Q найчастіше застосовують у кулонометричному титруванні.
VO3— +4H+. Кількість VO3– визначають при титруванні розчином FeSO4 (індикатор — фенілантранілова кислота). Хронометричним методом (К. при постійній силі струму) проводять визначення Q при незмінній силі струму протягом всього електролізу, час якого визначають секундоміром: Q = І·t, де І — сила електричного струму, А; t — час електролізу, с. Постійна сила струму забезпечується послідовним підключенням у ланцюг високоомного опору (10–25 тис. Ом), напруга — 100–200 В. Хронометричний метод визначення кількості електрики Q найчастіше застосовують у кулонометричному титруванні.
Потенціостатична К. базується на утриманні постійного значення потенціалу робочого електрода впродовж усього процесу електролізу. Сила струму І поступово зменшується при зниженні концентрації речовини, яку визначають. Експериментальна залежність сили струму від часу електролізу відображає експоненціальна крива (рис. 1) або напівлогарифмічна залежність ln I = f(t) (рис. 2).
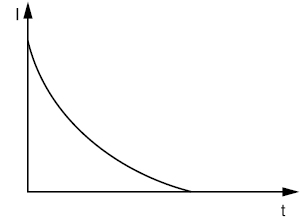
Рис. 1. Залежність сили струму від часу електролізу при потенціостатичній кулонометрії
Кількість електрики Q обчислюють за рівнянням Q = I0 /tg α, де I0 — початкова сила струму; tg α — тангенс кута нахилу прямої I = f(t) за графіком (див. рис. 2). Нахил кривої визначають за декількома точками на початку електролізу, що дає змогу обчислити кількість електрики, не завершуючи електролізу, що скорочує термін досліду.
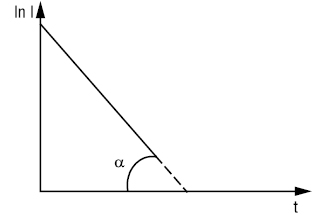
Рис.2. Напівлогарифмічна залежність сили струму від часу електролізу при потенціостатичній кулонометрії
У фармацевтичному аналізі методом К. визначають кількісний вміст похідних барбітурової кислоти, антибіотиків, атропіну, кодеїну, папаверину, сульфаніламідів, цистеїну тощо.
Основы аналитической химии: В 2 кн. — Кн. 2. Методы химического анализа / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и др. — М., 1999; Брутко Л.И., Гриценко С.В. Руководство по количественному анализу лекарственных препаратов. — М., 1978.
